题目内容
 向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )
向10.00mL0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/LNaOH溶液,溶液PH值变化曲线如图所示.下列说法不正确的是( )| A、HA是弱酸 |
| B、c点时,V=10.00ml |
| C、b点表示的溶液中:2c(Na+)=c(A-)+c(HA) |
| D、b、c、d点表示的溶液中c(Na+)+c(H+)=c(A-)+c(OH-) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:由图象知,0.01mol/L的HA溶液的pH值约为4,不能完全电离,为弱酸,加入的酸的物质的量=0.01mol/L×0.01L=10-4 mol,碱的物质的量=0.01mol/L×0.005L=5×10-5 mol,溶液溶质为NaA和HA,溶液呈酸性,说明HA的电离程度大于A-的水解程度,c点时,溶液呈中性,如V=10.00 mL,二者恰好反应,溶液应呈碱性,则实际加入NaOH溶液的体积应小于10mL,结合电荷守恒解答该题.
解答:
解:A.由图象知,0.01mol/L的HA溶液的pH值约为4,不能完全电离,为弱酸,故A正确;
B.c点时,溶液呈中性,如V=10.00 mL,二者恰好反应,溶液应呈碱性,则实际加入NaOH溶液的体积应小于10mL,故B错误;
C.b点时,加入的酸的物质的量=0.01mol/L×0.01L=10-4 mol,碱的物质的量=0.01mol/L×0.005L=5×10-5 mol,溶液溶质为NaA和HA,溶液呈酸性,存在:2c(Na+)=c(A-)+c(HA),故C正确;
D.溶液中呈电中性,溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(A-)+c(OH-),故D正确.
故选:B.
B.c点时,溶液呈中性,如V=10.00 mL,二者恰好反应,溶液应呈碱性,则实际加入NaOH溶液的体积应小于10mL,故B错误;
C.b点时,加入的酸的物质的量=0.01mol/L×0.01L=10-4 mol,碱的物质的量=0.01mol/L×0.005L=5×10-5 mol,溶液溶质为NaA和HA,溶液呈酸性,存在:2c(Na+)=c(A-)+c(HA),故C正确;
D.溶液中呈电中性,溶液中阴阳离子所带电荷相等,即c(Na+)+c(H+)=c(A-)+c(OH-),故D正确.
故选:B.
点评:本题考查了酸碱混合时溶液中各种离子的关系,为高考常见题型,侧重于学生的分析能力的考查,难度较大,会运用电荷守恒和物料守恒是解本题的关键,注意把握弱电解质的电离和盐类水解的特点.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
下列各项表达式正确的是( )
A、N2的电子式: |
B、H2O2的电子式: |
C、NaCl的电子式: |
D、F-的结构示意图: |
在加入铝能放出气体的某无色溶液中,下列离子可能大量共存的是( )
| A、NH4+、Mg2+、Ba2+、HCO3-、Cl- |
| B、Na+、Cu2+、Ca2+、SO42-、NO3- |
| C、CO32-、Mg2+、NH4+、SO42-、Cl- |
| D、K+、Na+、Cl-、SiO32-、NO3- |
下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A、铝片与稀盐酸反应 |
| B、灼热的炭与二氧化碳反应 |
| C、甲烷在氧气中燃烧 |
| D、Ba(OH)2?8H2O与NH4Cl反应 |
如图为香芹酮分子的结构,下列有关叙述正确的是( )


| A、香芹酮化学式为C9H12O |
| B、香芹酮可以发生加成反应、消去反应和氧化反应 |
| C、香芹酮能使酸性KMnO4溶液退色 |
| D、香芹酮分子中有3种官能团 |
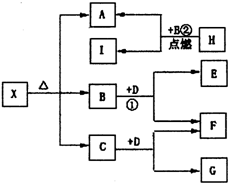 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
 A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素.其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子.请回答下列有关问题:
A、B、C、D、E、F为前四周期原子序数依次增大的非稀有气体元素.其中:A的一种单质是自然界最硬的物质;B与A同周期且基态原子中s能级与p能级上的电子数相等;C于B同主族;D为同周期电负性最大的元素;E为使用最为广泛的金属;F的基态原子中没有单电子.请回答下列有关问题: