题目内容
常温下,下列有关HNO3溶液的叙述正确的是( )
| A、该溶液中,K+、Fe2+、SO42-、Br-可以大量共存 |
| B、溶液pH=1时,由水电离出的氢离子浓度为1×10-13 mol/L |
| C、1L 0.1mol/L该溶液和足量的Zn充分反应,生成1.12L H2 |
| D、稀溶液中通SO2反应的离子方程式为:2SO2+H2O+2NO3-=2SO42-+2NO↑+2H+ |
考点:硝酸的化学性质
专题:
分析:A.硝酸具有强的氧化性,能够氧化二价铁离子;
B.酸性溶液中水的电离受到抑制,由水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,依据Kw=C(H+)C(OH-);
C.硝酸具有强的氧化性,与金属反应不生成氢气;
D.稀溶液中通SO2反应生成硫酸、一氧化氮和水.
B.酸性溶液中水的电离受到抑制,由水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,依据Kw=C(H+)C(OH-);
C.硝酸具有强的氧化性,与金属反应不生成氢气;
D.稀溶液中通SO2反应生成硫酸、一氧化氮和水.
解答:
解:A.硝酸具有强的氧化性,能够氧化二价铁离子,所以二价铁离子不能大量共存,故A错误;
B.溶液pH=1时,C(H+)=0.1mol/L,由水电离出的氢离子浓度等于溶液中氢氧根离子的浓度=
=
=1×10-13 mol/L,故B正确;
C.硝酸具有强的氧化性,与金属反应不生成氢气,故C错误;
D.稀溶液中通SO2反应的离子方程式为:3SO2+2H2O+2H++2NO3-=3SO42-+2NO↑+6H+,故D错误;
故选:B.
B.溶液pH=1时,C(H+)=0.1mol/L,由水电离出的氢离子浓度等于溶液中氢氧根离子的浓度=
| Kw |
| C(H+) |
| 10-14 |
| 0.1 |
C.硝酸具有强的氧化性,与金属反应不生成氢气,故C错误;
D.稀溶液中通SO2反应的离子方程式为:3SO2+2H2O+2H++2NO3-=3SO42-+2NO↑+6H+,故D错误;
故选:B.
点评:本题考查了硝酸的性质,熟悉硝酸的强氧化性是解题关键,注意水电离平衡的影响因素,题目难度不大.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
按要求填空
(1)最简单烯烃的结构简式: ;
(2)相对分子质量最小的有机物的结构式: ;
(3)乙烯与溴化氢反应方程式: ,反应类型 ;
(4)在浓硫酸作用下,苯与浓硝酸在60℃反应方程式: ,反应类型 .
(1)最简单烯烃的结构简式:
(2)相对分子质量最小的有机物的结构式:
(3)乙烯与溴化氢反应方程式:
(4)在浓硫酸作用下,苯与浓硝酸在60℃反应方程式:
 将反应5IO3-+I-+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流 计指针再次发生偏转.下列判断不正确的是( )
将反应5IO3-+I-+6H+?3I2+3H2O设计成如图所示的原电池.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流 计指针再次发生偏转.下列判断不正确的是( )| A、开始加入少量浓硫酸时,乙中石墨电极上发生氧化反应 |
| B、开始加入少量浓硫酸时,同时在甲、乙烧杯中都加入淀粉溶液,只有乙烧杯中溶液变蓝 |
| C、电流计读数为零时,反应达到化学平衡状态 |
| D、两次电流计指针偏转方向相反 |
在加入铝能放出气体的某无色溶液中,下列离子可能大量共存的是( )
| A、NH4+、Mg2+、Ba2+、HCO3-、Cl- |
| B、Na+、Cu2+、Ca2+、SO42-、NO3- |
| C、CO32-、Mg2+、NH4+、SO42-、Cl- |
| D、K+、Na+、Cl-、SiO32-、NO3- |
下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A、铝片与稀盐酸反应 |
| B、灼热的炭与二氧化碳反应 |
| C、甲烷在氧气中燃烧 |
| D、Ba(OH)2?8H2O与NH4Cl反应 |
如图为香芹酮分子的结构,下列有关叙述正确的是( )


| A、香芹酮化学式为C9H12O |
| B、香芹酮可以发生加成反应、消去反应和氧化反应 |
| C、香芹酮能使酸性KMnO4溶液退色 |
| D、香芹酮分子中有3种官能团 |
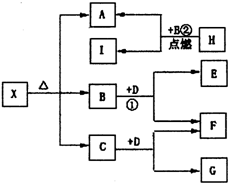 已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.
已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系. 已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大.X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题: