题目内容
10.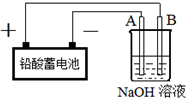 Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑装置如图所示,回答下列问题
Cu2O是一种半导体材料,实验室用铅酸蓄电池电解一定浓度的NaOH溶液制备Cu2O,方程式为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑装置如图所示,回答下列问题已知铅酸蓄电池的电池反应为PbO2+Pb+2H2SO?$?_{充电}^{放电}$ 2PbSO4+2H2O
(1)制备过程中铅酸蓄电池正极电极反应式PbO2+2e-+4H++SO42-=PbSO4+2H2O
(2)A、B电极反应式为A2H2O+2e-=H2↑+2OH-、B4OH--4e-=O2↑+2H2O
(3)制备过程中,每生成1molCu2O,电路中转移2mol电子,消耗2mol H2SO?
分析 (1)铅酸蓄电池正极电极反应式PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)A与电源的负相连、B与电源的正极相连,所以A是阴极发生还原反应,B是阳极发生氧化反应;
(3)根据Cu2O~~2e-~~2H2SO4,由此分析.
解答 解:(1)铅酸蓄电池正极电极反应式PbO2+2e-+4H++SO42-=PbSO4+2H2O,故答案为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
(2)A与电源的负相连、B与电源的正极相连,所以A是阴极发生还原反应,电极反应式为2H2O+2e-=H2↑+2OH-;B是阳极发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O,故答案为:2H2O+2e-=H2↑+2OH-;4OH--4e-=O2↑+2H2O;
(3)根据Cu2O~~2e-~~2H2SO4,所以每生成1molCu2O,电路中转移2mol的电子,消耗2mol的硫酸,故答案为:2;2.
点评 本题考查学生电解池的工作原理及相关计算,注意把握电解池的阴阳极上的电极反应,题目难度不大,侧重于基本原理的应用的考查.

练习册系列答案
相关题目
20.下列物质中一定不是天然高分子化合物的是( )
| A. | 橡胶 | B. | 蛋白质 | C. | 油脂 | D. | 淀粉 |
1.下列有关说法不正确的是( )
| A. | 硫(俗称硫磺)是一种黄色晶体,质脆.不溶于水,易溶于酒精 | |
| B. | 硅酸钠的水溶液俗称水玻璃,是制备硅胶和木材防火剂的重要原料 | |
| C. | 氧化铝是冶炼金属铝的原料,也是比较好的耐火材料,可用来制造耐火坩埚、耐火管 | |
| D. | FeO是一种黑色粉末,不稳定,在空气中受热,迅速被氧化成Fe3O4 |
18.下列有关命名的说法正确的是( )
| A. | 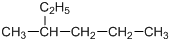 主链上的碳原子数是5 主链上的碳原子数是5 | B. |  名称是3甲基2丁烯 名称是3甲基2丁烯 | ||
| C. | 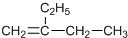 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | D. | 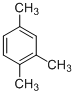 的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
5.已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3kJ/mol,下列说法中正确的是( )
| A. | 浓硫酸和NaOH溶液反应,生成 l mol水时放热57.3 kJ | |
| B. | 含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ | |
| C. | 1L 0.l mol/L CH3COOH与1L 0.l mol/L NaOH溶液反应后放热为5.73 kJ | |
| D. | 1L 0.l mol/L HNO3与 1L 0.l mol/L NaOH溶液反应后放热为 5.73 kJ |
15.下列说法或表示正确的是( )
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B时△H=+119 kJ/mol 可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含l mol NaOH的溶液混合,放出的热量大于57.3kJ | |
| D. | 在101kPa时,H2燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol,则H2在101kPa时的燃烧热为571.6kJ/mol |
2.下列叙述正确的是( )
| A. | 常温常压下,1.5 mol N2的体积约为33.6 L | |
| B. | NaOH的摩尔质量是40 g | |
| C. | 150mL 1 mol/LNaCl溶液与100mL 1 mol/LAlCl3溶液中的n(Cl-)相等 | |
| D. | 同温同压下,相同体积的C12和SO2气体所含的分子数一定相同 |
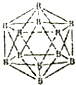 晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )
晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图).若其中有两个原子为10B,其余为11B,则该结构单元结构类型有( )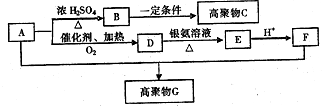 有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化:
有机物A常用作有机合成的中间体.15.2g该有机物燃烧生成26.4gCO2和14.4gH2O;质谱图表明其相对分子质量为76,红外光谱分析表明A分子中含有O-H键和C-O键.核磁共振氢谱上有三个峰,峰面积之比为2:1:1.A能发生如图转化: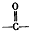 ,则H的结构简式可能为CH3CH2CHO、
,则H的结构简式可能为CH3CH2CHO、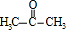 .
.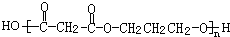 +(2n-1)H2O.
+(2n-1)H2O.