题目内容
20.甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-443.64kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)a=-1453.28 kJ•mol-1 |
分析 A.燃烧热规定可燃物的物质的量为1mol;
B.放热反应中,反应物的总能量大于生成物的总能量;
C.甲醇完全燃烧生成液态水的热化学方程式未知;
D.设①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-443.64kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
由盖斯定律可知①×2+②可得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g).
解答 解:A.由2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1可知,CO的燃烧热为$\frac{1}{2}$×566.0 kJ•mol-1=283.0kJ•mol-1,故A错误;
B.CO燃烧为放热反应,2 mol CO和1 mol O2的总能量比2 mol CO2的总能量高,故B错误;
C.甲醇完全燃烧生成液态水的热化学方程式未知,因此不能计算,故C错误;
D.设①CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-443.64kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
由盖斯定律可知①×2+②可得2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=(-443.64kJ•mol-1)×2-566.0kJ•mol-1=1453.28 kJ•mol-1,故D正确;
故选D.
点评 本题考查了燃烧热和盖斯定律,难度不大,明确燃烧热的内涵和外延,掌握热化学方程式的计算方法是解题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列物质中能通过化合反应制得,且生成该物质的化合反应既可以是氧化还原反应,又可以是非氧化还原反应的是( )
| A. | H2SO4 | B. | Na2O2 | C. | Fe(OH)3 | D. | AlCl3 |
5.能与Na2CO3溶液反应生成CO2,且与 互为同分异构体的芳香族化合物有(不考虑立体异构)( )
互为同分异构体的芳香族化合物有(不考虑立体异构)( )
 互为同分异构体的芳香族化合物有(不考虑立体异构)( )
互为同分异构体的芳香族化合物有(不考虑立体异构)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
9.将0.2mol•L-1HCN溶液和0.1mol•L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
| A. | [HCN]<[CN-] | B. | [Na+]<[CN-] | ||
| C. | [HCN]-[CN-]=[OH-] | D. | [HCN]+[CN-]=0.1mol•L-1 |
 在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.
在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.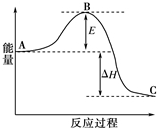 合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.