题目内容
5. 合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)?2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变小(填“大”或“小”).
(2)起始充入2mol•L-1 N2和5.5mol•L-1 H2,经过50min,NH3的浓度为1mol•L-1,则v(N2)=0.01mol•L-1•min-1、C(H2)=4mol•L-1;
(3)已知NH3(g)=NH3 (l)△H=-QkJ•mol-1,书写N2(g)+3H2(g)═2NH3 (l)的热化学方程式N2(g)+3H2(g)═2NH3 (l)△H=-(92.2+2Q)kJ•mol-1.
分析 (1)使用催化剂改变反应途径,降低活化能;
(2)根据浓度变化量之比等于化学计量数之比计算△c(N2)、△c(H2),再根据v=$\frac{△c}{△t}$计算v(N2),氢气浓度=氢气起始浓度-氢气浓度变化量;
(3)生成17g NH3(g),放出46.1kJ的热量,则生成2mol NH3(g),放出92.2kJ的热量,可得热化学方程式:①.N2(g)+3H2(g)═2NH3 (g)△H=-92.2kJ/mol,
又知:②.NH3(g)=NH3 (l)△H=-QkJ•mol-1
根据盖斯定律,①+②×2可得:N2(g)+3H2(g)═2NH3 (l).
解答 解:(1)使用催化剂改变反应途径,降低活化能,故图中E变小,
故答案为:小;
(2)△c(N2)=$\frac{1}{2}$△c(NH3)=$\frac{1}{2}$×1mol/L=0.5mol/L,则v(N2)=$\frac{0.5mol/L}{50min}$=0.01mol/(L.min),
△c(H2)=$\frac{3}{2}$△c(NH3)=$\frac{3}{2}$×1mol/L=1.5mol/L,c(N2)=5.5mol/L-1.5mol/L=4mol/L,
故答案为:0.01;4;
(3)生成17g NH3(g),放出46.1kJ的热量,则生成2mol NH3(g),放出92.2kJ的热量,可得热化学方程式:①.N2(g)+3H2(g)═2NH3 (g)△H=-92.2kJ/mol,
又知:②.NH3(g)=NH3 (l)△H=-QkJ•mol-1
根据盖斯定律,①+②×2可得:N2(g)+3H2(g)═2NH3 (l)△H=-(92.2+2Q)kJ•mol-1,
故答案为:N2(g)+3H2(g)═2NH3 (l)△H=-(92.2+2Q)kJ•mol-1.
点评 本题考查化学反应速率计算、化学平衡计算、盖斯定律应用等,比较基础,有利于基础知识的巩固.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 ,下列有关说法中错误的是( )
,下列有关说法中错误的是( )| A. | 在碱溶液中易变质 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 分子式为C13H16O2 | |
| D. | 与HCl恰好完全加成时可得到一种纯净物 |
已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-443.64kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)a=-1453.28 kJ•mol-1 |
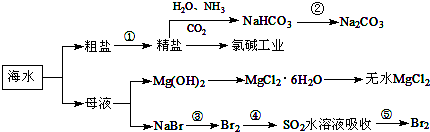
| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
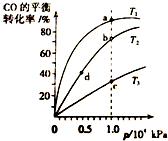 用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
用CO合成甲醇的反应为:CO(g)+2H2(g)═CH3OH (g)△H<0.按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )| A. | 温度:T1>T2>T3 | B. | 正反应速率:v(a)>v(c) v(b)>v(d) | ||
| C. | 平衡常数:K(a)>K(b) K(b)=K(d) | D. | 平均摩尔质量:M(a)>M(c) M(b)<M(d) |
 氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是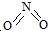 和
和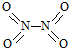 .实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.
.实验测得N-N键键能为167kJ•mol-1,NO2中氮氧键的平均键能为466kJ•mol-1,N2O4中氮氧键的平均键能为438.5kJ•mol-1.(1)写出N2O4转化为NO2的热化学方程式:N2O4(g)?2NO2(g)△H=+57 kJ•mol-1
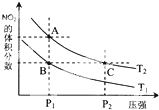
(2)对反应N2O4(g)?2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(3)在100℃时,将0.40mol的NO2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.050 | n2 | 0.080 | 0.080 |
②n3=n4(填“>”、“<”或“=”),该反应的平衡常数K的值为2.8,升高温度后,反应2NO2?N2O4的平衡常数K将减小(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器充入的是N2O4气体,要达到上述同样的平衡状态,N2O4的起始浓度是0.10mol•L-1.

