题目内容
将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
Ag2SO4(s)?Ag2O(s)+SO3(g) 2SO3(g)?2SO2(g)+O2(g)
经10分钟反应达到平衡,此时c(SO3)=0.4mol/L,c(O2)=0.05mol/L,下列叙述不正确的是( )
| A、SO3的分解率为20% |
| B、10分钟内ν(SO2)=0.01mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、加压,容器内固体的质量不变 |
考点:难溶电解质的溶解平衡及沉淀转化的本质,化学平衡的计算
专题:
分析:已知①Ag2SO4(s)?Ag2O(s)+SO3(g),②2SO3(g)?2SO2(g)+O2(g),平衡时c (O2)=0.05mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,以此解答该题.
解答:
解:已知①Ag2SO4(s)?Ag2O(s)+SO3(g),②2SO3(g)?2SO2(g)+O2(g),平衡时c (SO2)=0.1mol/L,则由反应②可知消耗SO30.1mol/L,测得c (SO3)=0.4mol/L,可知反应①共生成SO3的浓度为0.4mol/L+0.1mol/L=0.5mol/L,
A.反应②中SO3的分解率为
=20%,故A正确;
B.在这10min内氧气的平均反应速率为
=0.005mol/(L?min),所以ν(SO2)=0.01mol/(L?min),故B正确;
C.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为
=40g/L,故C正确;
D.加压时,反应Ag2SO4(s)?Ag2O(s)+SO3(g) 逆向移动,固体质量增加,故D错误.
故选D.
A.反应②中SO3的分解率为
| 0.1 |
| 0.5 |
B.在这10min内氧气的平均反应速率为
| 0.05mol/L |
| 10min |
C.c (SO2)=0.1mol/L,则c (O2)=0.05mol/L,设容器体积为1L,则容器里气体的密度为
| 0.4mol/L×1L×80g/mol+0.1mol/L×1L×64g/mol+0.05mol/L×1L×32g/mol |
| 1L |
D.加压时,反应Ag2SO4(s)?Ag2O(s)+SO3(g) 逆向移动,固体质量增加,故D错误.
故选D.
点评:本题考查化学平衡的计算,题目难度不大,注意根据两个反应的浓度关系结合方程式进行计算,易错点为D,注意平衡常数的意义和表达式.

练习册系列答案
相关题目
相同状况下,20mL气体A2和10mL气体B2恰好化合生成20mL气体C,则C的化学式为( )
| A、AB |
| B、AB2 |
| C、A2B |
| D、A2B3 |
A、B、C都是有机化合物,有如下转化关系:A
B
C,A的相对分子质量比B小18,B的相对分子质量比C大2,A是衡量一个国家石油化工业水平的重要标志之一的一种常见气体.以下说法正确的是( )
| +水 |
| 消去 |
| 催化氧化 |
| A、A是乙炔,B是乙醇 |
| B、A是乙烯,C是乙醛 |
| C、A是乙烯,C是乙醇 |
| D、A是环己烷,C是苯 |
下表是元素周期表的一部分.X、Y、Z、W均为短周期元素,Z元素原子最外层电子数与电子总数之比为3:8.下列说法错误的是( )
| X | Y | ||
| Z | W |
| A、Z的气态氢化物比W的气态氢化物稳定 |
| B、原子半径由大到小的顺序为:X>Y |
| C、X元素只能形成一种单质 |
| D、Y元素可形成多种氧化物 |
下列装置或操作能达到实验目的是( )
A、 检查装置气密性 |
B、 从碘的CCl4溶液中分离出碘 |
C、 除去甲烷中乙烯 |
D、 分离甲苯与乙醇 |
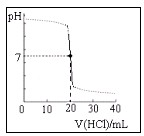 用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00ml,滴定曲线如图所示.则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol/L)( )
用某浓度的HCl溶液滴定某浓度的NaOH溶液25.00ml,滴定曲线如图所示.则HCl溶液与NaOH溶液的物质的量浓度可能是(单位:mol/L)( )