题目内容
下列措施肯定能使反应速率增大的是( )
| A、增大反应物的量 |
| B、增大压强 |
| C、适当升高温度 |
| D、降低反应物浓度 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:一般增大反应物的浓度、增大压强,升高温度、使用催化剂,化学反应速率加快,以此来解答.
解答:
解:A.若反应物为纯固体或纯液体,增大反应物的量,反应速率不变,故A错误;
B.若反应中没有气体参加和生成,为溶液中的反应,则增加压强,反应速率不变,故B错误;
C.因升高温度,活化分子百分数增大,反应速率加快,故C正确;
D.降低反应物浓度可减慢反应速率,故D错误;
故选C.
B.若反应中没有气体参加和生成,为溶液中的反应,则增加压强,反应速率不变,故B错误;
C.因升高温度,活化分子百分数增大,反应速率加快,故C正确;
D.降低反应物浓度可减慢反应速率,故D错误;
故选C.
点评:本题考查影响化学反应速率的因素,题目难度不大,注意常见影响化学反应速率的因素除温度、浓度、压强、催化剂之后还有表面积、溶剂、光照等因素,注意常见基础知识的积累.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
 某硫酸盐A的两种阳离子由常见的短周期元素组成,将该盐溶于水,向溶液中滴加烧碱溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示,下列离子在溶液中能大量共存,加入晶体A后,仍能大量共存的是( )
某硫酸盐A的两种阳离子由常见的短周期元素组成,将该盐溶于水,向溶液中滴加烧碱溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示,下列离子在溶液中能大量共存,加入晶体A后,仍能大量共存的是( )| A、Na+、K+、Cl-、OH- |
| B、Mg2+、Fe3+、Br-、HCO3- |
| C、K+、Ba2+、NO3-、I- |
| D、Na+、H+、Cl-、NO3- |
 一定温度下,在2L的密闭容器中发生反应:A(g)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如下图.下列有关说法不正确的是( )
一定温度下,在2L的密闭容器中发生反应:A(g)+2B(g)?xC(g)△H<0,B、C的物质的量随时间变化的关系如下图.下列有关说法不正确的是( )| A、x=2 |
| B、反应开始2min内,v(C)=0.1mol?L-1?min-1 |
| C、2min后,降低温度平衡向右移动 |
| D、当容器内混合气体压强不再改变时,反应体系达到化学平衡状态 |
下列物质中,属于电解质且能够导电的是( )
| A、Cu丝 |
| B、熔融的NaOH |
| C、NaCl溶液 |
| D、液态氯化氢 |
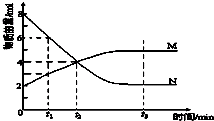 一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
一定温度下在2L的密闭容器内进行反应,M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )| A、反应的化学方程式:2M?N |
| B、t2时,正、逆反应速率相等,达到平衡 |
| C、平衡时,N的转化率为75% |
| D、若t1=2min,用N的浓度表示的化学反应速率为0.5 mol?(L?s)-1 |
镁粉与一定量某浓度的盐酸反应,但反应速度太快,为减慢反应速度,且不影响产生H2的总量,可向盐酸中加入的物质是( )
| A、Na2CO3 |
| B、CH3COONa |
| C、NaOH |
| D、NaHCO3 |
下列叙述中不 正确的是( )
| A、石英沙、水晶的主要成分都是SiO2 |
| B、SiO2是制光导纤维的主要原料 |
| C、石灰石是制普通玻璃、水泥的原料之一 |
| D、SiO2与水反应直接制得硅酸 |
硝酸铵(NH4NO3)在不同条件下分解可得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是( )
| A、HNO3、NO、H2O |
| B、N2、HNO3、H2O |
| C、N2、O2、H2O |
| D、N2O、H2O |
下列说法正确的是( )
A、已知0.1mol?L-1的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中
| ||
| B、25℃时,向水中加入少量固体CH3COONa,水的电离平衡:H2O?H++OH-逆向移动,c(H+)降低 | ||
| C、取c(H+)=0.01mol?L-1的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03 g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | ||
| D、向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3-) |