题目内容
镁粉与一定量某浓度的盐酸反应,但反应速度太快,为减慢反应速度,且不影响产生H2的总量,可向盐酸中加入的物质是( )
| A、Na2CO3 |
| B、CH3COONa |
| C、NaOH |
| D、NaHCO3 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:根据发生的反应为Mg+2H+═Mg2++H2↑,则减小氢离子的浓度而不改变氢离子的物质的量即可满足减慢反应速率,但又不影响产生氢气的总量,以此来解答.
解答:
解:A、加入Na2CO3固体,与盐酸反应生成二氧化碳,减少氢气的生成总量,故A错误;
B、CH3COONa固体,存在平衡CH3COO-+H+?CH3COOH,氢离子浓度降低,不影响氢离子的总的物质的量,不影响生成的氢气的总量,故B正确;
C、加入NaOH溶液,中和氢离子,减小氢离子的浓度,同时氢离子的物质的量减少,减慢反应速率,同时生成H2的总量减小,故C错误;
D、加入NaHCO3固体,与盐酸反应生成二氧化碳,减少氢气的生成总量,故D错误;
故选B.
B、CH3COONa固体,存在平衡CH3COO-+H+?CH3COOH,氢离子浓度降低,不影响氢离子的总的物质的量,不影响生成的氢气的总量,故B正确;
C、加入NaOH溶液,中和氢离子,减小氢离子的浓度,同时氢离子的物质的量减少,减慢反应速率,同时生成H2的总量减小,故C错误;
D、加入NaHCO3固体,与盐酸反应生成二氧化碳,减少氢气的生成总量,故D错误;
故选B.
点评:本题以化学反应来考查影响反应速率的因素,明确氢离子浓度减小是减慢反应速率的关键,注意C选项容易忽略水解.

练习册系列答案
相关题目
取一定量的饱和氯水与CaCO3粉末混合,观察到氯水的黄绿色褪去,静置后取上层澄清溶液四份,分别进行以下实验:
①一份滴加盐酸,产生大量气泡;
②一份滴加NaOH溶液,出现白色沉淀
③一份用酒精灯加热出现白色沉淀;
④将有色布条浸入第四份溶液,布条立即褪色
根据以上判断下列说法中错误的是( )
①一份滴加盐酸,产生大量气泡;
②一份滴加NaOH溶液,出现白色沉淀
③一份用酒精灯加热出现白色沉淀;
④将有色布条浸入第四份溶液,布条立即褪色
根据以上判断下列说法中错误的是( )
| A、整个实验过程中未涉及氧化还原反应 |
| B、由①、②可知澄清溶液中的含有Ca(HCO3)2 |
| C、②、③中的白色沉淀为CaCO3 |
| D、由④可知澄清溶液中含有HClO |
微粒
X的质量数为137,中子数为81,则核外电子数为( )
A Z |
| A、54 | B、56 | C、58 | D、137 |
下列递变不正确的是( )
| A、Na、Mg、Al最外层电子数依次增多,其单质的还原性依次减弱 |
| B、P、S、Cl最高正价依次升高,对应气态氢化物稳定性增强 |
| C、C、N、O原子半径依次增大 |
| D、Na、K、Rb氧化物的水化物碱性依次增强 |
下列措施肯定能使反应速率增大的是( )
| A、增大反应物的量 |
| B、增大压强 |
| C、适当升高温度 |
| D、降低反应物浓度 |
下列关于燃烧热的描述中正确的是( )
| A、已知a g乙烯气体充分燃烧时生成1mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=-4b kJ?mol-1 | ||
B、将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
| ||
| C、H2(g)的燃烧热是285.8 kJ?mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
D、葡萄糖的燃烧热是2800 kJ?mol-1,则
|
相同质量的下列各烃,完全燃烧后生成水最多的是( )
| A、甲烷 | B、乙烷 | C、乙烯 | D、乙炔 |
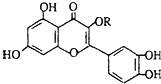 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P 的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P 的叙述错误的是( )| A、可以和溴水反应 |
| B、可用有机溶剂萃取 |
| C、分子中有二个苯环 |
| D、1mol维生素P可以和3molNaOH反应 |
下列物质不是同系物的有( )
| A、油酸和硬脂酸 |
| B、乙酸和硬脂酸 |
| C、乙酸和丁酸 |
| D、油酸和丙烯酸 |