题目内容
17.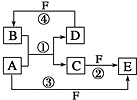 A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F 六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,B为无色气体,则A在周期表中的位 置为第三周期ⅡA族,反应④的化学方程式C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO2↑+4NO2↑.
(2)若A是常见的变价金属的单质,D、F均为气态单质,且F为黄绿色,光照条件下D与F会发生反应.已知反应①和②均在水溶液中进行,则检验C中阳离子的操作步骤是:取少量试液于试管中,加入氢氧化钠溶液,产生白色沉淀马上变成灰绿色最后变成红褐色.(或先加入KSCN溶液无现象,通入氯气后呈血红色).
(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,D是制取集成电路的主要原料,则B在通讯领域用来作光导纤维,反应①的化学方程式为SiO2+2 C$\frac{\underline{\;高温\;}}{\;}$Si+2 CO↑.
分析 (1)A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,D处于偶数族,则A为Mg,D为C,反应①为Mg与CO2的反应,F的浓溶液与A、D反应都有红棕色气体生成,F为浓硝酸,C为MgO;
(2)A是常见的变价金属的单质,D、F是气态单质,且F为黄绿色,则A为Fe,D为H2,F为Cl2,B为HCl,C为FeCl2,E为FeCl3;
(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,D是制取集成电路的主要原料,则A为C,D为Si,F为O2,B为SiO2,反应①为C与二氧化硅的反应.
解答 解:(1)A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,D处于偶数族,则A为Mg,D为C,反应①为Mg与CO2的反应,F的浓溶液与A、D反应都有红棕色气体生成,F为浓硝酸,C为MgO.Mg在周期表中的位置为第三周期ⅡA族,反应④的化学方程式:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO2↑+4NO2↑,
故答案为:三、ⅡA;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO2↑+4NO2↑;
(2)A是常见的变价金属的单质,D、F是气态单质,且F为黄绿色,则A为Fe,D为H2,F为Cl2,B为HCl,C为FeCl2,E为FeCl3,则检验C中阳离子的操作步骤是:取少量试液于试管中,加入氢氧化钠溶液,产生白色沉淀马上变成灰绿色最后变成红褐色.(或先加入KSCN溶液无现象,通入氯气后呈血红色),
故答案为:取少量试液于试管中,加入氢氧化钠溶液,产生白色沉淀马上变成灰绿色最后变成红褐色.(或先加入KSCN溶液无现象,通入氯气后呈血红色);
(3)A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,D是制取集成电路的主要原料,则A为C,D为Si,F为O2,B为SiO2,反应①为C与二氧化硅的反应,二氧化硅在通讯领域用来作光导纤维,反应①的化学方程式为:SiO2+2 C$\frac{\underline{\;高温\;}}{\;}$Si+2 CO↑,
故答案为:光导纤维;SiO2+2 C$\frac{\underline{\;高温\;}}{\;}$Si+2 CO↑.
点评 本题考查无机物的推断,物质的颜色、特殊性质及特殊反应等是推断突破口,熟练掌握元素的位置及元素单质化合物的性质.

 习题精选系列答案
习题精选系列答案| A. | 体系总压强不再随时间而改变 | B. | 体系总质量不再随时间而改变 | ||
| C. | NO(g)和NO2(g)的生成速率相同 | D. | SO3(g)和NO(g)的浓度比为1:1 |
| A. | ${\;}_{6}^{13}$C的质量数是13,原子序数是6,核内有6个中子 | |
| B. | ${\;}_{6}^{13}$C的是碳的一种核素,与${\;}_{6}^{12}$C互为同位素 | |
| C. | 碳元素的相对原子质量为13 | |
| D. | ${\;}_{6}^{13}$C的与金刚石、石墨、C60等互为同素异形体 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 放热反应 | B. | 化合反应 | C. | 吸热反应 | D. | 分解反应 |
| A. | x的原子半径大于y的原子半径 | |
| B. | x的第一电离能小于y 的第一电离能 | |
| C. | x阴离子的半径小于y阳离子的半径 | |
| D. | x的电负性大于y的电负性 |



 .
.


