题目内容
15.电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为 KOH 溶液,其电极反应式是:Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-..下列说法正确的是( )| A. | Zn 为正极,Ag2O 为负极 | |
| B. | 电解质溶液中,OH-移向 Ag2O 极 | |
| C. | 锌发生还原反应,氧化银发生氧化反应 | |
| D. | 原电池工作时,正极区溶液 pH 值增大 |
分析 根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,则正极为Ag2O,得电子发生还原反应;正极反应和负极反应加和,得到总反应式为:Ag2O+Zn═2Ag+ZnO,氢氧根离子的物质的量没变化但溶剂的量减少,所以碱性增大;电池工作时带负电荷的阴离子应该移向负极,带正电荷的离子移向正极,根据电极反应式判断.
解答 解:A、根据化合价变化可知Zn被氧化,发生氧化反应,应为原电池的负极,则正极为Ag2O,故A错误;
B、电池工作时带负电荷的阴离子应该移向负极,即电解质溶液中,OH-移向Zn极,故B错误;
C、Zn被氧化,发生氧化反应,正极为Ag2O,得电子发生还原反应,故C错误;
D、原电池工作时,正极区发生反:Ag2O+H2O+2e-═2Ag+2OH-,正极区溶液 pH 值增大,故D正确.
故选D.
点评 本题考查原电池知识,题目难度不大,要注意电极反应式的应用,难度中等.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
3.二氧化氮能形成二聚分子:2NO2(g)?N2O4(g)正反应放热,现欲测定NO2分子的相对质量,应采取的措施是( )
| A. | 高温、低压 | B. | 低温、高压 | C. | 低温、低压 | D. | 高温、高压 |
20.A、B、C、D四种有机物的碳原子数目相同.标准状况下烃A对氢气的相对密度是13;烃B跟HBr反应生成C;C与D混合后加入NaOH并加热可生成B.则D为( )
| A. | C2H5Cl | B. | C2H4Cl2 | C. | C2H6 | D. | C2H5OH |
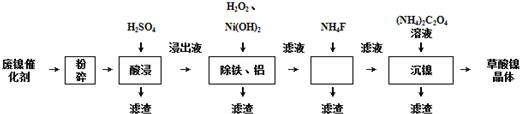
4.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率,提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7,第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如表(开始沉淀的pH按金属离子浓度为0.1mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不产生沉淀,则Ni2+已经沉淀完全;洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失,将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7,第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.

 ②CO2
②CO2
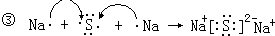 ④H2O
④H2O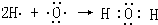 .
. 利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
利用电化学原理将CO、SO2转化为重要化工原料,装置如图所示:
 +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$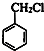 +HCl.
+HCl. 不能发生的化学反应是b(填序号).
不能发生的化学反应是b(填序号). (写出一种即可).
(写出一种即可). .
.