题目内容
17.短周期元素X、Y、Z在周期表中的位置如表所示,则下列说法正确的是( )| X | ||
| Y | ||
| Z |
| A. | Z一定是活泼的金属 | |
| B. | Y的最高化合价为+7价 | |
| C. | Z的最高价氧化物的水化物是强酸 | |
| D. | 1molY单质与足量水反应时,有2mol电子发生转移 |
分析 短周期元素X、Y、Z在周期表中的位置如表所示,则X为He元素,Y位于第二周期ⅤⅡA族,为F元素,Z位于第三周期ⅥA族元素,为S元素,据此结合元素周期律知识解答.
解答 解:根据分析可知:X为He元素,Y为F元素,Z位S元素,
A.Z为S元素,S为非金属元素,故A错误;
B.Y为F元素,F为非金属性最强的元素,没有正化合价,故B错误;
C.Z为S元素,S的最高价氧化物对应水合物为硫酸,硫酸为强酸,故C正确;
D.Y的单质为F2,1mol F2与水反应生成2molHF,转移了2mol电子,故D正确;
故选CD.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,明确元素周期表的结构为解答关键,注意熟练掌握原子结构与元素周期律的关系,试题培养了学生的灵活应用能力.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
17.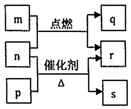 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
 短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:X<Y<Z | |
| B. | 非金属性:X>Y>Z | |
| C. | W、X、Y、Z四种元素可形成离子化合物 | |
| D. | q与s均为酸性氧化物,m的水溶液显酸性 |
5.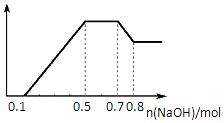 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
 某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含CO32-,可能含有SO42- | |
| B. | 溶液中n(NH4+)=0.2mol | |
| C. | 溶液中的阳离子只有H+、Mg2+、Al3+ | |
| D. | n(H+):n(Al3+):n(Mg2+)=1:1:1 |
9.科学家于2000年合成了第116号元素(元素符号Lv).有关新质量数为293的Lv原子的描述错误的是( )
| A. | 质子数116 | B. | 中子数177 | ||
| C. | 电子数116 | D. | 该原子可表示为:${\;}_{116}^{177}$Lv |
6.Na+、Mg2+、F-、O2-四种离子具有相同的电子层结构.则四种元素原子半径由大到小的顺序分别是( )
| A. | Mg>Na>F>O | B. | O>F>Na>Mg | C. | Na>Mg>O>F | D. | O>F>Na>Mg |
7.有关有机物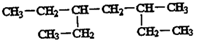 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )
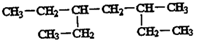 的下列说法中,不正确的是( )
的下列说法中,不正确的是( )| A. | 该有机物属于烷烃 | |
| B. | 该有机物与3-甲基-5-乙基辛烷互为同系物 | |
| C. | 该有机物与2,5-二甲基一3-乙基己烷互为同分异构体 | |
| D. | 该有机物命名时,主链上的碳原子数为6 |
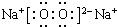 ,其中含有的化学键是离子键、共价键.
,其中含有的化学键是离子键、共价键.