题目内容
12.表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题: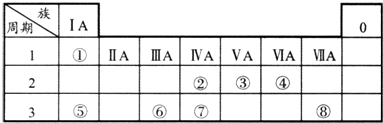
(1)④⑤⑥的简单离子半径由大到小的顺序为O2->Na+>Al3+(填离子符号).
(2)②③⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3 (填化学式).
(3)④和⑤的单质常温可以反应生成化合物A,用电子式表示化合物A的形成过程
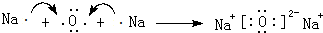 .
.(4)①④⑤⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式
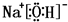 或
或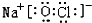 .
.(5)由①④两种元素形成常见液态化合物,该化合物可使酸性高锰酸钾溶液褪色,写出该离子方程式2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
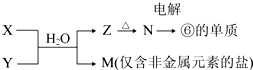
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,足量单质⑥与等物质的量的硫酸和氢氧化钠溶液反应生成氢气的物质的量之比为2:3.
分析 由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)由于同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性越强,最高价含氧酸的酸性越强;
(3)④和⑤的单质常温反应生成化合物A为Na2O,由钠离子与氧离子构成;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等;
(5)由①④两种元素形成常见液态化合物,该化合物可使酸性高锰酸钾溶液褪色,则该化合物为H2O2,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,反应生成锰离子、氧气与水;
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应;
根据2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,计算生成氢气体积之比.
解答 解:由元素在周期表中的位置可知:①为H,②为C,③为N,④为O,⑤为Na,⑥为Al,⑦为Si,⑧为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(2)非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HNO3>H2CO3>H2SiO3 ,
故答案为:HNO3>H2CO3>H2SiO3 ;
(3)④和⑤的单质常温反应生成化合物A为Na2O,由钠离子与氧离子构成,用电子式表示形成过程为: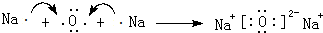 ,
,
故答案为: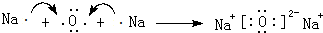 ;
;
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物有NaOH、NaClO等,对应的电子式为: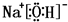 、
、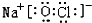 ,
,
故答案为: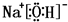 或
或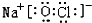 ;
;
(5)(5)由①④两种元素形成常见液态化合物,该化合物可使酸性高锰酸钾溶液褪色,则该化合物为H2O2,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,反应生成锰离子、氧气与水,反应离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑;
(6)M是仅含非金属的盐,所以M一定是铵盐,Z→N→⑥的单质,⑥为Al,推断N是氧化铝,Z是氢氧化铝,根据产物结合反应:X+Y+H2O→Al(OH)3+NH4+ 可知,该反应为铝盐和一水合氨的反应,则X溶液与Y溶液反应的离子方程式为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+,
假设硫酸与氢氧化钠均为1mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知生成氢气体积之比为1mol:1.5mol=2:3,
故答案为:Al3++3NH3+3H2O=Al(OH)3↓+3NH4+;2:3.
点评 本题考查元素周期表与元素周期律、元素化合物推断等,侧重对元素周期律与化学用语的考查,注意对元素周期表的整体把握,难度中等.

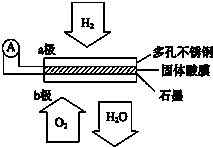 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
| A. | 70 | B. | 114 | C. | 184 | D. | 289 |
| A. | ClCH2=CH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH═CH2+NaCl | |
| B. | CH2=CHCH3+Cl2→CH2ClCHClCH3 | |
| C. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$ +HCl +HCl | |
| D. |  +HONO2$→_{△}^{浓硫酸}$ +HONO2$→_{△}^{浓硫酸}$ +H2O +H2O |
| A. | 17g OH-中含有的电子数为10 NA | |
| B. | 标准状况下,将2.24L Cl2溶于水,可得到HClO分子的数目是0.1NA | |
| C. | NA个Fe(OH)3胶体粒子的质量为107g | |
| D. | 44克14C16O2含氧原子数为2NA |
 元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的原子序数为6 | |
| B. | 该元素所有原子的质子数均为6 | |
| C. | 该元素的原子质量为12.01 g | |
| D. | 该元素应有多种同位素,所有原子的中子数不都为6 |
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是: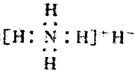 | |
| C. | 与水反应时,是还原剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
| A. | 键能越大,键长越短,分子越稳定 | |
| B. | 同主族元素从上到下第一电离能减小 | |
| C. | 同周期主族元素从左到右,第一电离能都不断增大 | |
| D. | 共价键都有饱和性,但不一定都有方向性 |

