题目内容
20.石油是一种极其重要的资源,是发展国民经济和国防建设重要物资.B的产量通常用来衡量一个国家的石油化工水平,A是生活中常见的有机物,易溶于水并有特殊香味.
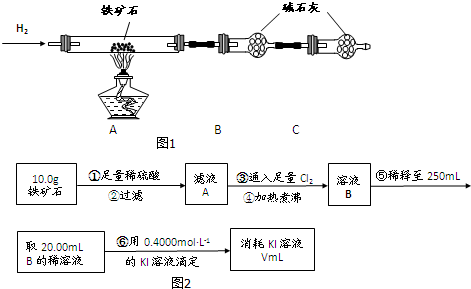
Ⅰ、有关物质转化关系如图1所示:
(1)足量烃B通入溴水的实验现象是溴水的橙色褪去,下层有无色油状液体生成.
(2)反应②属于加成反应反应(填有机反应类型).
(3)写出反应④的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
Ⅱ、某化学兴趣小组对反应③进行探究活动,设计如图2装置进行实验:
(4)在实验中球形干燥管除起冷凝外,另一个重要作用是防止液体倒吸.
(5)反应结束后b中的现象是面上有透明的不溶于水的油状液体生成,并可以闻到香味.
分析 B的产量可衡量一个国家石油化工发展的水平,B是乙烯,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,根据框图中信息,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是乙醇,根据框图中的转化关系、反应条件和反应试剂可推得,C是乙酸乙酯,D是乙醛,E是乙醇钠,据此解答.
解答 解:B的产量可衡量一个国家石油化工发展的水平,B是乙烯,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,根据框图中信息,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是乙醇,根据框图中的转化关系、反应条件和反应试剂可推得,C是乙酸乙酯,D是乙醛,E是乙醇钠,
Ⅰ(1)乙烯能与溴发生加成反应生成1,2-二溴乙烷,所以足量乙烯通入溴水中溴水的橙色褪去,下层有无色油状液体生成,
故答案为:溴水的橙色褪去,下层有无色油状液体生成;
(2)反应②是乙烯与水发生加成反应得乙醇,
故答案为:加成反应;
(3)反应④是乙醇在铜作催化剂、加热条件下催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
Ⅱ(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用是防止液体倒吸,
故答案为:防止液体倒吸;
(5)试管b中观察到的现象是:液体分层,上层无色油状液体有果香味,
故答案为:面上有透明的不溶于水的油状液体生成,并可以闻到香味.
点评 考查有机推断、乙酸乙酯的制取,涉及烯、醇、羧酸的性质与转化等,难度不大,是对常见有机物知识的简单运用,注意掌握各类有机物的性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.将少量金属钠放入盛有CuSO4溶液的烧杯中,烧杯中发生的反应是( )
①2Na+CuSO4═Na2SO4+Cu
②Cu+2H2O═Cu(OH)2↓+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.
①2Na+CuSO4═Na2SO4+Cu
②Cu+2H2O═Cu(OH)2↓+H2↑
③2Na+2H2O═2NaOH+H2↑
④2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.
| A. | ① | B. | ①② | C. | ③④ | D. | ①③ |
10.下列关于金属的描述不正确的是( )
| A. | 金属单质都有还原性 | |
| B. | 镁、铝虽然还原性较强,但可以直接置于空气中保存,是因为表面能形成致密的氧化膜,保护了内层的金属 | |
| C. | 铝箔在酒精灯上加热后熔化但不滴落,是因为表面形成的Al2O3层熔点很高 | |
| D. | 钠和镁可以剧烈地燃烧,铝和铁则不能燃烧 |
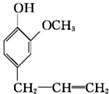 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: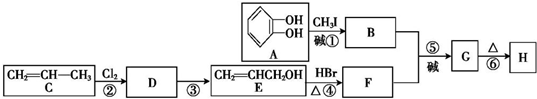
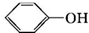 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$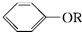 +HX(X代表卤素原子);
+HX(X代表卤素原子);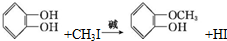 .
. .
.
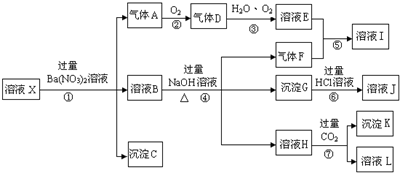
 ,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.
,沉淀K的化学式为:Al(OH)3,沉淀G的化学式为:Fe(OH)3,实验中,可以观察到反应②的现象是:气体由无色变红棕色.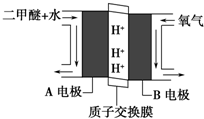 (1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.
(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径.目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚气体的燃烧热为1455kJ•mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚.下列有关叙述正确的是AC.