题目内容
在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时,N2和H2的浓度比是 ;
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 .(填“变大”“变小”或“不变”)
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”).达到新平衡后,容器内温度 (填“大于”“小于”或“等于”)原来的2倍.
(1)当反应达到平衡时,N2和H2的浓度比是
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量
(3)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将
考点:化学平衡的影响因素
专题:化学平衡专题
分析:(1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断;
(2)反应是放热反应,升温平衡逆向进行,气体质量不变,物质的量增大,密度ρ=
;
(3)运用勒夏特列原理解答.
(2)反应是放热反应,升温平衡逆向进行,气体质量不变,物质的量增大,密度ρ=
| m |
| V |
(3)运用勒夏特列原理解答.
解答:
解:(1)依据起始量氮气和氢气物质的量之比等于反应之比分析判断,在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)?2NH3(g),反应物起始量之比等于化学方程式中的反应之比,所以平衡浓度为1:3,故答案为:1:3;
(2)N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),反应是放热反应,升温平衡逆向进行,气体质量不变,物气体质的量增大,M=
可知,混和气体的平均相对分子质量减小;混合气体质量和体积不变,平衡后气体密度ρ=
,所以密度不变;
故答案为:变小;不变;
(3)升温,平衡向吸热的逆向移动,使体系温度降低,故答案为:向左移动;小于.
(2)N2(g)+3H2(g)?2NH3(g)(正反应为放热反应),反应是放热反应,升温平衡逆向进行,气体质量不变,物气体质的量增大,M=
| m |
| n |
| m |
| V |
故答案为:变小;不变;
(3)升温,平衡向吸热的逆向移动,使体系温度降低,故答案为:向左移动;小于.
点评:本题考查了化学平衡计算分析,影响化学平衡的因素分析判断,反应特征和平衡移动原理是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知:T℃时,CaCO3的Ksp为1.0×10-10,CaF2的Ksp为4.0×10-12下列说法正确的是( )
| A、T℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大 |
| B、T℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体 |
| C、T℃时,CaF2固体在20mL0.01 mol?L-1盐酸中的Ksp比在纯水中的Ksp大 |
| D、T℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能转化为CaF2 |
一定温度下,关于PH=1的醋酸溶液的下列说法中正确的是( )
| A、加入等体积的水,c(H+)、c(OH-)都减小 |
| B、加水稀释时醋酸和水的电离度都增大 |
| C、加入少量醋酸钠固体pH 一定降低 |
| D、稀释100倍pH变为3 |
瓦斯中甲烷与氧气的质量比为1:4时极易发生爆炸,则此时甲烷与氧气的体积比是( )
| A、1:1 | B、1:2 |
| C、1:4 | D、1:8 |
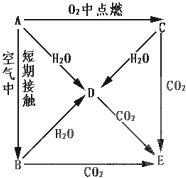 A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.
A、B、C、D、E五种物质都含有同一种活泼金属元素,它们按图所示关系相互转化,已知A为单质.