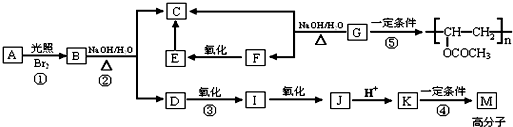
题目内容
已知FeSO4在高温下分解生成Fe2O3、SO3和SO2用如图所示装置设计实验,检验FeSO4在高温下分解生成的气态物质,并测定已分解的FeSO4质量.
已知:B装置、烧瓶E中所加试剂依次为氢氧化钠溶液、水(滴有数滴BaCl2溶液),请回答下列问题:
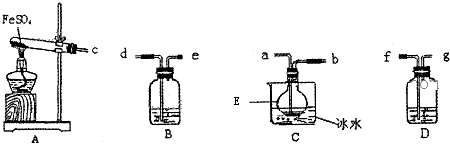
(1)D装置中所加试剂名称 .
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:c→ →e.
(3)检验后,用烧瓶E中混合物测定已分解的FeSO4质量,此实验操作的第一步: ;第二步:过滤混合物,在过滤器上将沉淀洗净后,灼烧并冷却至室温,称量其质量为ag,再次灼烧冷却至室温称量其质量为bg,且b<a,继续灼烧、冷却并称重,直到连续两次称量的质量差不超过0.1g为止.
(4)若最终得到沉淀cg,则已经分解的FeSO4质量 (填计算式).
已知:B装置、烧瓶E中所加试剂依次为氢氧化钠溶液、水(滴有数滴BaCl2溶液),请回答下列问题:

(1)D装置中所加试剂名称
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:c→
(3)检验后,用烧瓶E中混合物测定已分解的FeSO4质量,此实验操作的第一步:
(4)若最终得到沉淀cg,则已经分解的FeSO4质量
考点:探究物质的组成或测量物质的含量,性质实验方案的设计
专题:实验探究和数据处理题
分析:A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;E中三氧化硫和氯化钡反应生成硫酸钡沉淀,通过硫酸钡的质量可计算硫酸亚铁的质量,据此分析.
(1)用品红检验SO2气体;
(2)A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;
(3)测定已分解的FeSO4的质量,应使SO3气体完全反应;
(4)c为硫酸钡的质量,三氧化硫的物质的量与硫酸钡的物质的量相等,根据反应方程式:2FeSO4
Fe2O3+SO2↑+SO3↑可知分解的硫酸亚铁的物质的量为三氧化硫的2倍,据此计算硫酸亚铁质量.
(1)用品红检验SO2气体;
(2)A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;
(3)测定已分解的FeSO4的质量,应使SO3气体完全反应;
(4)c为硫酸钡的质量,三氧化硫的物质的量与硫酸钡的物质的量相等,根据反应方程式:2FeSO4
| ||
解答:
解:(1)SO2气体具有漂白性,可使品红溶液褪色,故D装置中装有品红溶液,检验二氧化硫的生成,故答案为:品红试液;
(2)A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;
故答案为:abfgd;
(3)测定已分解的FeSO4的质量,应使SO3气体完全生成BaSO3沉淀,否则会有较大误差,故答案为:向E中逐滴加入氯化钡溶液,直到不再产生新的沉淀为止;
(4)cg为硫酸钡的质量,硫酸钡的物质的量为:
=
mol,因三氧化硫的物质的量与硫酸钡的物质的量相等,根据反应方程式:2FeSO4
Fe2O3+SO2↑+SO3↑可知分解的硫酸亚铁的物质的量为:
mol,已分解硫酸亚铁的质量为:
mol×152g/mol,故答案为:
mol×152g/mol.
(2)A装置为FeSO4在高温下分解生成Fe2O3、SO3和SO2的装置,三氧化硫易和水反应生成硫酸,三氧化硫熔点高,故先用冰水混合物使三氧化硫液化,即c和a相连,检验二氧化硫用品红溶液,故D中装有品红溶液,即b和f相连,二氧化硫有毒,会污染空气,故用氢氧化钠溶液吸收,即g和d相连;
故答案为:abfgd;
(3)测定已分解的FeSO4的质量,应使SO3气体完全生成BaSO3沉淀,否则会有较大误差,故答案为:向E中逐滴加入氯化钡溶液,直到不再产生新的沉淀为止;
(4)cg为硫酸钡的质量,硫酸钡的物质的量为:
| cg |
| 233g/mol |
| c |
| 233 |
| ||
| 2c |
| 233 |
| 2c |
| 233 |
| 2c |
| 233 |
点评:本题考查物质的分离和检验,做题时要抓住题给信息,充分把握物质的性质,这是解答元素化合物知识的关键之处,本题有一定难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
苹果酸的结构简式为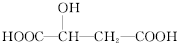 ,下列说法正确的是( )
,下列说法正确的是( )
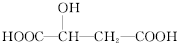 ,下列说法正确的是( )
,下列说法正确的是( )A、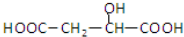 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
| D、四联苯的一氯代物有5种 |
在无色透明的强酸性溶液中,下列离子组能大量共存的是( )
| A、Na+、K+、OH-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、K+、NH4+、Cl-、Cu2+ |