题目内容
在无色透明的强酸性溶液中,下列离子组能大量共存的是( )
| A、Na+、K+、OH-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、K+、NH4+、Cl-、Cu2+ |
考点:离子共存问题
专题:
分析:溶液无色说明不含有颜色的离子,溶液呈强酸性,则不能存在和氢离子反应的离子,且溶液中离子之间不能生成气体、沉淀、弱电解质、络合物或发生氧化还原反应、双水解反应,据此分析解答.
解答:
解:溶液无色说明不含有颜色的离子,溶液呈强酸性,说明含有大量氢离子,
A.H+、OH-反应生成水,所以不能大量共存,故A错误;
B.酸性条件下,H+、CO32-反应生成二氧化碳和水,且Ba2+、CO32-生成碳酸钡沉淀,所以不能大量共存,故B错误;
C.这几种离子无色且相互之间不反应,都和氢离子不反应,所以能大量共存,故C正确;
D.铜离子呈蓝色,不符合无色条件,故D错误;
故选C.
A.H+、OH-反应生成水,所以不能大量共存,故A错误;
B.酸性条件下,H+、CO32-反应生成二氧化碳和水,且Ba2+、CO32-生成碳酸钡沉淀,所以不能大量共存,故B错误;
C.这几种离子无色且相互之间不反应,都和氢离子不反应,所以能大量共存,故C正确;
D.铜离子呈蓝色,不符合无色条件,故D错误;
故选C.
点评:本题考查离子共存,为高考高频点,明确离子性质及离子反应条件是解本题关键,注意结合题给限制性条件下解答,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
已知Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2═2CuO+4NO2↑+O2↑,将少量Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,下列说法正确的是( )
| A、NO2能支持燃烧 |
| B、NO2不能支持燃烧 |
| C、木条复燃是因为硝酸铜分解产生了氧气的缘故 |
| D、木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果 |
下列说法正确的是( )
| A、将少量的CO2气体通入足量次氯酸钠溶液中的离子方程式为:ClO+CO2+H2O═HCO3-+HClO,可得出电离平衡常数K1(H2CO3)>K(HClO)>K2(H2CO3) |
| B、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1.0×10-3 mol?L-1的AgNO3溶液和1.0×10-3 mol?L-1的K2CrO4溶液混合,不会有沉淀生成 |
| C、相同物质的量浓度的下列溶液:①NH4HS O4 ②NH4Cl ③NH3?H2O,水电离程度由大到小的顺序是:①>②>③ |
| D、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
在 1L K2SO4、CuSO4的混合溶液中,c(SO42-)=2mol?L-1,用石墨作电极电解此溶液,当通电一段时间后(电解完全),两极均收集到22.4L气体(标准状况),原溶液中c(K+)为( )
| A、0.5 mol?L-1 |
| B、1 mol?L-1 |
| C、1.5 mol?L-1 |
| D、2 mol?L-1 |
邻苯二甲醛(X)在碱性条件下发生歧化(即自身氧化还原)反应,再经酸化得到化合物Y.Y可在浓硫酸存在的条件下生成含五元环的化合物Z.则下列说法正确的是( )
| A、邻二甲苯不可用作生产X的原料 |
| B、Y可发生银镜反应 |
| C、Y可与FeCl3发生显色反应 |
| D、Z与X的相对分子质量相等 |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A、氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e-=4OH- | ||||
B、用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液的离子方程式为:2C1-+2H2O
| ||||
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ | ||||
| D、钢铁发生电化学腐蚀的负极反应式:Fe-2e-=Fe2+ |
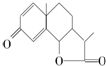 是一种驱虫药--山道年的结构简式,试确定其分子式为
是一种驱虫药--山道年的结构简式,试确定其分子式为