题目内容
化学科研小组的同学在研究Na2SO3的热稳定性和精确测试Na2SO3溶液的pH时,遇到了困惑.为此他们进行了冷静的思考和准备,决心重新实验,揭开奥秘.请你根据所学的中学化学知识,参与交流讨论.
【查阅资料】
①常温下0.1mol?L-1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1mol?L-1的H2S溶液的pH约为4.5.
【实验操作】
①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,溶液澄清,测得pH=10.3.
【分析猜想】
Na2SO3?7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
【交流讨论】
(1)他们将恒重后的样品溶于水配成溶液时,为加速溶解,可采取的措施是 .
(2)实验操作②中称量操作至少进行 次.
(3)给Na2SO3?7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明. .
(4)猜想Na2SO3在高温强热下发生分解反应的化学方程式是 .
(5)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是 .实验③中溶液的pH=10.3的原理是(以主要的离子方程式表示) .
(6)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论. .
【查阅资料】
①常温下0.1mol?L-1的H2SO3溶液的pH约为2.1.
②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1mol?L-1的H2S溶液的pH约为4.5.
【实验操作】
①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②以坩埚再次准确称取25.20g上述晶体,继而隔绝空气在600℃以上高温下强热至恒重,质量为12.60g.
③将②所得之12.60g固体进行元素定性定量分析,组成与Na2SO3无异.将其溶于水得250mL溶液,溶液澄清,测得pH=10.3.
【分析猜想】
Na2SO3?7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)
【交流讨论】
(1)他们将恒重后的样品溶于水配成溶液时,为加速溶解,可采取的措施是
(2)实验操作②中称量操作至少进行
(3)给Na2SO3?7H2O加热时要隔绝空气,请以简要的文字和化学方程式给以说明.
(4)猜想Na2SO3在高温强热下发生分解反应的化学方程式是
(5)实验①和③中,两次测得的溶液pH相差明显,其合理的解释是
(6)请你设计简单的实验方案,给上述分析、猜想及解释以佐证.请简单叙述实验步骤、现象和结论.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)加热或搅拌均可加速溶解;
(2)将晶体加热到横重,保证结晶水全部失去的操作至少要进行4次;
(3)亚硫酸钠具有强的还原性,易被氧气氧化为硫酸钠;
(4)Na2SO3在高温强热下发生分解反应是一个自身氧化还原反应,会生成低价硫和高价硫;
(5)硫离子和亚硫酸根离子均能发生水解使得溶液显碱性,水解程度不一样而碱性强弱不一样;
(6)根据硫离子能和酸反应生成硫化氢、硫酸根离子可以和钡离子反应生成硫酸钡来回答.
(2)将晶体加热到横重,保证结晶水全部失去的操作至少要进行4次;
(3)亚硫酸钠具有强的还原性,易被氧气氧化为硫酸钠;
(4)Na2SO3在高温强热下发生分解反应是一个自身氧化还原反应,会生成低价硫和高价硫;
(5)硫离子和亚硫酸根离子均能发生水解使得溶液显碱性,水解程度不一样而碱性强弱不一样;
(6)根据硫离子能和酸反应生成硫化氢、硫酸根离子可以和钡离子反应生成硫酸钡来回答.
解答:
解:(1)升高温度可增加物质的溶解度,加速溶解,搅拌可混合均匀,加速溶解;故答案为:升高温度或搅拌;
(2)将晶体加热到恒重,保证结晶水全部失去的操作至少要进行4次,第三次和第四次的质量差不超过0.1g,表明结晶水全部失去,故答案为:4;
(3)亚硫酸钠具有强的还原性,Na2SO3?7H2O加热时要隔绝空气,防止亚硫酸钠被氧气氧化为硫酸钠,即2Na2SO3+O2=2Na2SO4;
故答案为:避免Na2SO3被空气中氧气氧化,2Na2SO3+O2=2Na2SO4;
(4)Na2SO3在高温强热下发生分解反应是一个自身氧化还原反应,会生成-2价硫和+6价的硫,反应为:4Na2SO3
Na2S+3Na2SO4,故答案为:4Na2SO3
Na2S+3Na2SO4;
(5)硫离子和亚硫酸根离子均能发生水解使得溶液显碱性,实验①和③中,两次测得的溶液pH相差明显,是因为二者的水解程度不一样而导致碱性强弱不一样,实验③中溶液的pH=10.3的原理是S2-+H2O?HS-+OH-,
故答案为:实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强;S2-+H2O?HS-+OH-;
(6)硫离子能和酸反应生成硫化氢,硫离子的检验方法:取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-,硫酸根离子可以和钡离子反应生成硫酸钡,硫酸根离子的检验方法:另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-,
故答案为:取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-;另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-.
(2)将晶体加热到恒重,保证结晶水全部失去的操作至少要进行4次,第三次和第四次的质量差不超过0.1g,表明结晶水全部失去,故答案为:4;
(3)亚硫酸钠具有强的还原性,Na2SO3?7H2O加热时要隔绝空气,防止亚硫酸钠被氧气氧化为硫酸钠,即2Na2SO3+O2=2Na2SO4;
故答案为:避免Na2SO3被空气中氧气氧化,2Na2SO3+O2=2Na2SO4;
(4)Na2SO3在高温强热下发生分解反应是一个自身氧化还原反应,会生成-2价硫和+6价的硫,反应为:4Na2SO3
| ||
| ||
(5)硫离子和亚硫酸根离子均能发生水解使得溶液显碱性,实验①和③中,两次测得的溶液pH相差明显,是因为二者的水解程度不一样而导致碱性强弱不一样,实验③中溶液的pH=10.3的原理是S2-+H2O?HS-+OH-,
故答案为:实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO32-,溶液的碱性强;S2-+H2O?HS-+OH-;
(6)硫离子能和酸反应生成硫化氢,硫离子的检验方法:取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-,硫酸根离子可以和钡离子反应生成硫酸钡,硫酸根离子的检验方法:另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-,
故答案为:取③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-;另取③中溶液适量于试管中,加入HCl酸化的BaCl2,如有白色沉淀生成,证明有SO42-.
点评:本题是一道信息迁移题,考查学生对知识的综合程度和解决问题的能力,难度大.充分利用题给信息“①常温下0.1mol?L-1的H2SO3溶液的pH约为2.1.②通常情况下,H2S为无色,有腐蛋臭味的气体,其水溶液称为氢硫酸.常温下0.1mol?L-1的H2S溶液的pH约为4.5及Na2SO3?7H2O在强热下,失去结晶水,进而发生了分解反应(自身氧化还原反应)”是解题关键.

练习册系列答案
相关题目
某溶液既能溶解Al(OH)3,又能溶解BaCO3且均形成溶液,在该溶液中可以大量共存的离子组是( )
| A、Fe3+、Mg2+、SO42-、NO3- |
| B、Ag+、Al3+、NO3-、OH- |
| C、Na+、Ba2+,Cl-、ClO- |
| D、K+、Na+、CO32-、NO3- |
下列反应中,不属于加成反应的是( )
| A、.乙炔与与氯化氢反应制取氯乙烯 |
| B、乙烷和氯气反应制取氯乙烷 |
| C、.乙烯与氢气反应制取乙烷 |
| D、.乙烯通入溴水,溴水褪色 |
下列说法正确的是( )
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D、属于共价化合物的电解质在熔化状态下一般不导电 |
对可逆反应2SO2+O2
2SO3,下列叙述正确的是( )
| 催化剂 |
| △ |
| A、反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(SO2):n(O2)=2:1 |
| B、反应达到平衡后,缩小容器体积,正反应速率加快,逆反应速率减慢,平衡正向移动 |
| C、反应达到平衡时,加入催化剂,速率加快,平衡常数增大 |
| D、当v正(SO2):v正(SO3)=1:1时,说明该化学反应已经达到平衡 |
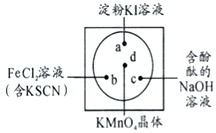 微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如下图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.