题目内容
25℃时,将一定量的冰醋酸(无水乙酸)加水稀释,稀释过程中溶液的导电性变化如图1所示.
请完成下列问题:
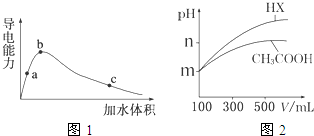
(1)上述a、b、c三点对应醋酸的电离程度最大的是 (填“a”、“b”、“c”),三点对应溶液中c(OH-)由大到小的顺序为 .
(2)c点对应的溶液中c(H+)与c(CH3COO-)+c(OH-)的关系为前者 (填“大于”“小于”“等于”)后者.
(3)从a点到b点,溶液中
的比值 (填“增大”、“减小”、“等于”).
(4)25℃时,体积均为100mL、pH=m的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示.则稀释前两溶液中c(OH-)= ,HX的电离平衡常数 (填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数.
(5)若用pH试纸进行实验,你能否区分上述HX和CH3COOH两种酸溶液?若能,请简述操作过程;若不能,请说明理由. .
请完成下列问题:

(1)上述a、b、c三点对应醋酸的电离程度最大的是
(2)c点对应的溶液中c(H+)与c(CH3COO-)+c(OH-)的关系为前者
(3)从a点到b点,溶液中
| cCH3COO- |
| cCH3COOH |
(4)25℃时,体积均为100mL、pH=m的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图2所示.则稀释前两溶液中c(OH-)=
(5)若用pH试纸进行实验,你能否区分上述HX和CH3COOH两种酸溶液?若能,请简述操作过程;若不能,请说明理由.
考点:弱电解质在水溶液中的电离平衡
专题:
分析:(1)溶液浓度越小,醋酸的电离程度越大;溶液中离子浓度越大其导电能力越强,氢离子浓度越大,氢氧根离子浓度越小;
(2)c点对应的溶液中根据电荷守恒判断;
(3)根据电离平衡常数是定值,结合从a点到b点氢离子浓度在变大分析;
(4)根据pH=-lgc(H+)计算出氢离子浓度,再根据Kw计算氢氧根浓度;由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(5)稀释会促进弱电解质的电离,故弱酸的PH变化小,据此分析;
(2)c点对应的溶液中根据电荷守恒判断;
(3)根据电离平衡常数是定值,结合从a点到b点氢离子浓度在变大分析;
(4)根据pH=-lgc(H+)计算出氢离子浓度,再根据Kw计算氢氧根浓度;由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;
(5)稀释会促进弱电解质的电离,故弱酸的PH变化小,据此分析;
解答:
解:(1)溶液体积越大,溶液浓度越小,醋酸的电离程度越大,所以a、b、c三点中醋酸的电离程度最大的是c,溶液中离子浓度越大其导电能力越强,所以氢离子浓度大小顺序是b>a>c,则c(OH-)由大到小的顺序为c>a>b;
故答案为:c;c>a>b;
(2)c点对应的溶液中根据电荷守恒,则有c(H+)=c(CH3COO-)+c(OH-),故答案为:等于;
(3)因为从a点到b点电离平衡常数是定值即
不变,又根据图象从a点到b点氢离子浓度在变大,所以溶液中
的比值在减小,故答案为:减小;
(4)根据pH=-lgc(H+)=m,则氢离子浓度为10-m,又Kw=c(H+)c(OH-)=10-14,所以氢氧根浓度为10m-14;由图可知,稀释相同的倍数,pH变化大的酸酸性强,由图可知,HX的pH变化程度大,则HX酸性强,电离平衡常数大,故答案为:10m-14;大于;
(5)稀释会促进弱电解质的电离,故弱酸的PH变化小,可鉴别,具体操作为:取等体积的两种溶液分别稀释100倍,用玻璃棒分别蘸取稀释后的两溶液滴在两张PH试纸上,其显示的颜色与比色卡对照,PH较大的是HX溶液;故答案为:能;取等体积的两种溶液分别稀释100倍,用玻璃棒分别蘸取稀释后的两溶液滴在两张PH试纸上,其显示的颜色与比色卡对照,PH较大的是HX溶液;
故答案为:c;c>a>b;
(2)c点对应的溶液中根据电荷守恒,则有c(H+)=c(CH3COO-)+c(OH-),故答案为:等于;
(3)因为从a点到b点电离平衡常数是定值即
| C(CH 3COO -)C(H +) |
| C(CH3COOH) |
| cCH3COO- |
| cCH3COOH |
(4)根据pH=-lgc(H+)=m,则氢离子浓度为10-m,又Kw=c(H+)c(OH-)=10-14,所以氢氧根浓度为10m-14;由图可知,稀释相同的倍数,pH变化大的酸酸性强,由图可知,HX的pH变化程度大,则HX酸性强,电离平衡常数大,故答案为:10m-14;大于;
(5)稀释会促进弱电解质的电离,故弱酸的PH变化小,可鉴别,具体操作为:取等体积的两种溶液分别稀释100倍,用玻璃棒分别蘸取稀释后的两溶液滴在两张PH试纸上,其显示的颜色与比色卡对照,PH较大的是HX溶液;故答案为:能;取等体积的两种溶液分别稀释100倍,用玻璃棒分别蘸取稀释后的两溶液滴在两张PH试纸上,其显示的颜色与比色卡对照,PH较大的是HX溶液;
点评:本题考查弱酸的电离及酸性的比较、pH与酸的稀释等,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等.

练习册系列答案
相关题目
下列说法正确的是( )
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 |
| C、CO2的水溶液导电能力很弱,所以CO2是弱电解质 |
| D、属于共价化合物的电解质在熔化状态下一般不导电 |
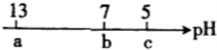 向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )
向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )| A、.当7<pH<13时,溶液中c(Na)>c(CH3COO)>c(OH)>C(H) |
| B、.当pH=7时,所加CH3COOH溶液的体积为10 mL |
| C、当5<pH<7时,溶液中c(CH3COO)>c(Na) |
| D、.继续滴加0.1 mol?L-1的CH3COOH溶液,溶液的pH最终可以变化至1 |
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成.下列说法不正确的是( )


| A、原料X与中间体Y互为同分异构体 |
| B、原料X可以使酸性KMnO4溶液褪色 |
| C、中间体Y能发生加成、取代、消去反应 |
| D、1 mol依曲替酯只能与1 mol NaOH发生反应 |
已知Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2═2CuO+4NO2↑+O2↑,将少量Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,下列说法正确的是( )
| A、NO2能支持燃烧 |
| B、NO2不能支持燃烧 |
| C、木条复燃是因为硝酸铜分解产生了氧气的缘故 |
| D、木条复燃是因为硝酸铜分解产生了氧气和二氧化氮共同作用的结果 |
