题目内容
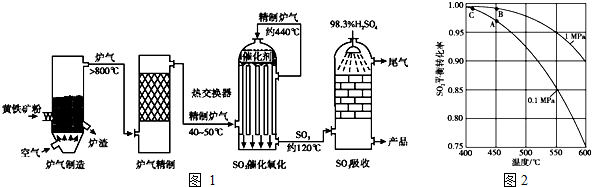
以黄铁矿为原料,采用接触法生产硫酸的流程可简示如图1:
请回答下列问题:
(1)在炉气制造中,生成SO2的化学方程式为 ;
(2)炉气精制的作用是将含SO2的炉气 、 和干燥,如果炉气不经过精制,对SO2催化氧化的影响是 ;
(3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图2所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 、 ;
(4)在SO2催化氧化设备中设置热交换器的目的是 、 ,从而充分利用能源.

请回答下列问题:
(1)在炉气制造中,生成SO2的化学方程式为
(2)炉气精制的作用是将含SO2的炉气
(3)精制炉气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强关系如图2所示.在实际生产中,SO2催化氧化反应的条件选择常压、450℃左右(对应图中A点),而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是
(4)在SO2催化氧化设备中设置热交换器的目的是
考点:工业制取硫酸
专题:化学应用
分析:(1)黄铁矿的主要成分是FeS2,在高温条件下与氧气反应:4FeS2+11O2
4Fe2O3+8SO2;
(2)在催化氧化时必须进行除尘、洗涤、干燥,以达到除去砷、硒等化合物的效果,这些物质会使催化剂中毒,并且水蒸气在高温下与铁反应,对设备和生产有不良影响;
(3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但反应较慢,450℃时,催化剂的催化效率最高;
(4)SO2催化氧化设备中设置热交换器可以充分利用反应放出的热.
| ||
(2)在催化氧化时必须进行除尘、洗涤、干燥,以达到除去砷、硒等化合物的效果,这些物质会使催化剂中毒,并且水蒸气在高温下与铁反应,对设备和生产有不良影响;
(3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但反应较慢,450℃时,催化剂的催化效率最高;
(4)SO2催化氧化设备中设置热交换器可以充分利用反应放出的热.
解答:
解:(1)黄铁矿的主要成分是FeS2,在高温条件下与氧气反应,其反应的化学方程式为:4FeS2+11O2
4Fe2O3+8SO2;
故答案为:4FeS2+11O2
4Fe2O3+8SO2;
(2)在催化氧化时必须进行除尘、洗涤、干燥,以达到除去砷、硒等化合物的效果,这些物质会使催化剂中毒,并且水蒸气在高温下与铁反应,对设备和生产有不良影响,
故答案为:除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响;
(3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高.
故答案为:不选择B点,因为压强越大对设备的投资大,消耗的动能大,SO2原料的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选择C点,因为温度越低,SO2转化率虽然更高,但催化作用受影响,450℃时,催化剂的催化效率最高,故不选C点;
(4)在S02催化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,冷却生成气体,可起到充分利用能源的目的,
故答案为:利用反应放出的热量预热原料气;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全.
| ||
故答案为:4FeS2+11O2
| ||
(2)在催化氧化时必须进行除尘、洗涤、干燥,以达到除去砷、硒等化合物的效果,这些物质会使催化剂中毒,并且水蒸气在高温下与铁反应,对设备和生产有不良影响,
故答案为:除尘、水洗;砷、硒等化合物会使催化剂中毒,水蒸气对设备和生产有不良影响;
(3)在反应2SO2+O2?2SO3中,SO2转化率较高,工业上一般不采用更高的压强,因为压强越大对设备的投资越大,消耗的动能越大.SO2的转化率在1个大气压下的转化率已达到97%左右,在提高压强,SO2的转化率提高的余地很小,本反应为放热反应,工业生产中不采取较低的温度,因为温度越低,SO2的转化率虽然更高,但催化剂的催化作用会受影响,450℃时,催化剂的催化效率最高.
故答案为:不选择B点,因为压强越大对设备的投资大,消耗的动能大,SO2原料的转化率已是97%左右,再提高压强,SO2的转化率提高的余地很小,所以采用1个大气压;不选择C点,因为温度越低,SO2转化率虽然更高,但催化作用受影响,450℃时,催化剂的催化效率最高,故不选C点;
(4)在S02催化氧化设备中设置热交换器,把不同温度之间的气体进行热交换,可预热反应气体,冷却生成气体,可起到充分利用能源的目的,
故答案为:利用反应放出的热量预热原料气;上层反应气经热交换器温度降到400~500℃进入下层使反应更加完全.
点评:本题考查硫酸的工业制法,涉及环境保护、反应原理、工业流程等问题,本题中注意炉气的精制、反应条件等问题的考查,是易错点,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法都正确的是( )
| 物 质 | 除杂试剂 | 分离方法 | |
| A | Cu(Fe) | 稀硫酸 | 过滤 |
| B | Cl2(HCl) | NaOH溶液 | 洗气 |
| C | I2(CCl4) | -- | 过滤 |
| D | Br2(H2O) | 酒精 | 萃取 |
| A、A | B、B | C、C | D、D |
“纳米材料”(1nm=10-9m )是指研究开发直径为几纳米至几十纳米的材料.如将“纳米材料”分散到某液体中,对于所得分散系的叙述不正确的是( )
| A、光束通过此分散系时会形成一条光亮的“通路” |
| B、此分散系中“纳米材料”的粒子在做不停的、无序的运动 |
| C、用滤纸过滤的方法可以从此分散系中分离得到该“纳米材料” |
| D、在外加电场作用下,“纳米材料”的粒子可能向某一极做定向运动 |
 氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法.
氯化铝融盐电解法是以氯化铝为原料,以碱金属或碱土金属氯化物(含少量MgCl2、KCl、CaCl2)为电解质进行电解制取铝的方法.