题目内容
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的最高价氧化物的对应水化物是一种强酸;Z的非金属性在同周期主族元素中最强.(1)写出X在周期表中的位置
(2)W的简单离子的还原性比Y简单离子的还原性
(3)Y与W形成的化合物和Z单质水溶液反应,生成二种强酸,该反应的化学方程式是
(4)已知25℃时,2.3g C2H5OH(l)在足量的W单质充分反应后恢复原状,放出68.34kJ热量,则该反应的热化学方程式:
(5)已知N2(g)+2O2(g)═2NO2(g);△H=+67.7kJ?mol-1,N2H4(g)+O2(g)═N2(g)+2H2O(g);△H=-534kJ?mol-1,根据盖斯定律写出肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据W的一种核素的质量数为18,中子数为10,则W的质子数为8,即W为氧元素;X和Ne原子的核外电子数相差1,则X为钠或氟,又由图可知X的原子半径比氧原子的半径大,则X为钠;再利用Y的最高价氧化物的对应水化物是一种强酸,Z的非金属性在同周期主族元素中最强及原子半径X>Y>Z来推断元素,然后利用元素的位置、原子的原子结构、化合物的结构和性质、C2H5OH燃烧时的能量以及盖斯定律书写热化学方程式来解答即可.
解答:
解:由信息及质子数+中子数=质量数,则W的质子数为18-10=8,则W为氧元素;由X和Ne原子的核外电子数相差1及X的原子半径比氧原子的半径大,则X为钠元素;
Y的最高价氧化物的对应水化物是一种强酸,Z的非金属性在同周期主族元素中最强及原子半径X>Y>Z,知Y为硫元素,Z为氯元素;
(1)X为钠元素,位于周期表中第三周期第ⅠA族,故答案为:第三周期 IA;
(2)W为氧元素,Y为硫元素,属同周期元素,因阴离子半径前者小于后者,所以W的简单离子的还原性比Y简单离子的还原性弱;Z为氯元素,因氯的非金属性强于溴,所以Z的气态氢化物和溴化氢相比,较稳定的是HCl,故答案为:弱;HCl;
(3)Y与W形成的化合物为SO2,与氯水反应生成二种强酸,反应为Cl2+SO2+2H2O═2HCl+H2SO4,故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;
(4)2.3g C2H5OH(l)的物质的量为
=0.05mol,25℃时,C2H5OH(l)在足量的W单质中充分反应后恢复原状,此时水为液体,放出68.34kJ热量,则C2H5OH(l)燃烧热为
=1366.8kJ?molmol-1,则该反应的热化学方程式为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1,
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1;
(5)①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ?mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=-534KJ?mol-1
将方程式2×②-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2×(-534KJ?mol-1)-(+67.7KJ?mol-1)=-1135.7kJ?mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1.
Y的最高价氧化物的对应水化物是一种强酸,Z的非金属性在同周期主族元素中最强及原子半径X>Y>Z,知Y为硫元素,Z为氯元素;
(1)X为钠元素,位于周期表中第三周期第ⅠA族,故答案为:第三周期 IA;
(2)W为氧元素,Y为硫元素,属同周期元素,因阴离子半径前者小于后者,所以W的简单离子的还原性比Y简单离子的还原性弱;Z为氯元素,因氯的非金属性强于溴,所以Z的气态氢化物和溴化氢相比,较稳定的是HCl,故答案为:弱;HCl;
(3)Y与W形成的化合物为SO2,与氯水反应生成二种强酸,反应为Cl2+SO2+2H2O═2HCl+H2SO4,故答案为:Cl2+SO2+2H2O═2HCl+H2SO4;
(4)2.3g C2H5OH(l)的物质的量为
| 2.3g |
| 46g?mol-1 |
| 68.34kJ |
| 0.05mol |
故答案为:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-1366.8 kJ?mol-1;
(5)①N2(g)+2O2(g)═2NO2(g)△H=+67.7KJ?mol-1;②N2H4(g)+O2(g)═N2(g)+2H2O (g)△H=-534KJ?mol-1
将方程式2×②-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2×(-534KJ?mol-1)-(+67.7KJ?mol-1)=-1135.7kJ?mol-1,
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1.
点评:本题考查位置、结构、性质的应用,学会寻找元素推断的突破口是解答的关键,并应熟悉元素化合物的性质、原子结构、盖斯定律应用、热化学反应方程式的书写方法来解答即可.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列溶液中的Cl-浓度与50mL 1.0mol?L-1 FeCl3溶液中的Cl-浓度相等的是( )
| A、100 mL 3.0 mol?L-1NaCl溶液 |
| B、75mL 1.0 mol?L-1CaCl2溶液 |
| C、150 mL 1.0mol?L-1KCl溶液 |
| D、100 mL 0.5 mol?L-1AlCl3溶液 |
下列物质中一定含有氢元素,不一定含有氧元素的是( )
①酸 ②酸式盐 ③碱 ④碱式盐 ⑤碱性氧化物.
①酸 ②酸式盐 ③碱 ④碱式盐 ⑤碱性氧化物.
| A、①② | B、①②③④ |
| C、②④ | D、①②④ |
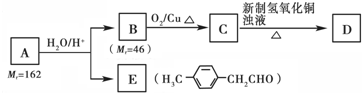
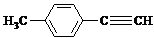 )的一条路线如下:
)的一条路线如下: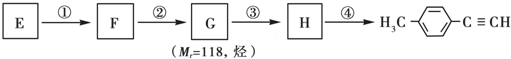
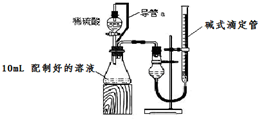 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.

 ,写出草酰氯(结构式:
,写出草酰氯(结构式: )与足量有机物D反应的化学方程式:
)与足量有机物D反应的化学方程式: ,由邻甲基苯酚经过两步反应可生成有机物A:邻甲基苯酚→中间产物→有机物A,请写出“中间产物”的结构简式
,由邻甲基苯酚经过两步反应可生成有机物A:邻甲基苯酚→中间产物→有机物A,请写出“中间产物”的结构简式