题目内容
5.如图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )
| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
分析 根据球棍模型可知该有机物为C6H5-CH2-CH(NH2)-COOH,含有氨基,具有碱性,可与酸反应,含有羧基,具有酸性,可与碱反应,为氨基酸,可发生缩聚反应生成高分子化合物,以此解答该题.
解答 解:A.由结构简式可确定分子式为C9H11O2N,故A正确;
B.分子中含有氨基和羧基,能缩聚为多肽,故B正确;
C.分子中含有苯环,在一定条件下可发生加成反应,故C正确;
D.分子中不含有能水解的官能团,如酯基、肽键等,故D错误.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重考查学生的分析能力,题目难度不大,注意根据结构模型明确有机物的种类是解答该题的关键,注意把握有机物官能团的性质.

练习册系列答案
相关题目
15.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 选项 | 混合物 | 除杂试剂 | 分离方法 |
| A | 己烷(己烯) | 溴的CCl4溶液 | 分液 |
| B | 溴乙烷(乙醇) | 水 | 分液 |
| C | 淀粉溶液(NaCl) | 水 | 过滤 |
| D | 皂化液(甘油) | NaCl | 盐析,分液 |
| A. | A | B. | B | C. | C | D. | D |
16.已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组成( )
| A. | CH3COO- | B. | NH4+ | C. | Fe2+ | D. | Ba2+ |
13.以下实验能获得成功的是( )
| A. | 用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
20. 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
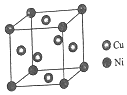
(4)某镍白铜合金的立方晶胞结构如图所示.
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
 根据以下背景资料,回答下列问题:
根据以下背景资料,回答下列问题:Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金.
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.
Ⅲ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2.
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H,碳原子的轨道杂化类型为sp3和sp2,所含σ键与π键的数目之比为7:1.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4的熔、沸点依次增高,原因是分子结构相似,分子量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
①晶胞中铜原子与镍原子的数量比为3:1.
②若合金的密度为dg/cm3,晶胞参数a=$\root{3}{\frac{251}{d{N}_{A}}}$×107nm.
10.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
17.4种相邻主族短周期元素的相对位置如表,元素X的原子核外电子数是M的2倍,Y的氧化物具有两性.回答下列问题:
(1)元素N在周期表中的位置是二周期VA族.
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.
| M | N | ||
| X | Y |
(2)X单质可采用电解熔融MgCl2的方法制备.
(3)M、N、Y三种元素最高价氧化物的水化物中,酸性最强的是HNO3,碱性最强的是Mg(OH)2(填化学式).二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O.
(4)气体分子(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O.