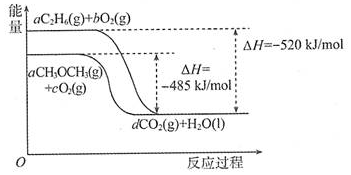
题目内容
14.氢气在氯气中充分燃烧,若两者的体积比为1:2,所得混合物用200mL3.0mol/L 的NaOH溶液(密度为1.12g/mL)恰好完全吸收.(1)求原NaOH溶液的质量分数.(结果用小数衷示,保留3位小数)
(2)求所得溶液中NaCl与NaClO的物质的量之和.
(3)求溶液中NaClO的物质的量.
分析 (1)根据m=ρV计算溶液的质量,根据m=cVM计算溶质的质量,再根据质量分数公式进行计算;
(2)氯气和氢气生成的氯化氢和氢氧化钠反应生成氯化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,根据原子守恒计算溶液中Cl-与ClO-的物质的量之和;
(3)根据剩余的氯气的物质的量计算次氯酸根离子的物质的量.
解答 解:(1)溶液的质量m=ρV=1.12g/mL×200mL=224g,溶质的质量m=cVM=3.0mol/L×0.2L×40g/mol=24g,所以其质量分数=$\frac{24g}{224g}$=0.107,
答:氢氧化钠溶液的质量分数是0.107;
(2)氯气和氢气生成的氯化氢和氢氧化钠反应生成氯化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,2NaOH+Cl2=NaCl+NaClO+H2O、NaOH+HCl=NaCl+H2O知,n(Cl2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×3.00mol/L×0.2L=0.3mol,再根据原子守恒知,所得溶液中NaCl与NaClO的物质的量之和=2 n(Cl2)=0.6mol,
答:所得溶液中NaCl与NaClO的物质的量之和为0.6mol;
(3)根据H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、2NaOH+Cl2=NaCl+NaClO+H2O、NaOH+HCl=NaCl+H2O知,有一半的氯气和氢氧化钠反应生成氯化钠和次氯酸钠,氯气和氢氧化钠的反应中有一半的氯气生成次氯酸钠,所以一共有$\frac{1}{4}$的氯气生成次氯酸钠,则溶液中NaClO的物质的量=$\frac{1}{4}$n(Cl2)=0.15mol,
答:溶液中NaClO的物质的量是0.15mol.
点评 本题考查了物质的量的有关计算,利用原子守恒、物质间的反应进行计算,难度中等.


| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
| A. | 油脂能在碱性条件下水解,可用于工业上制取肥皂 | |
| B. | 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘 | |
| C. | 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂 | |
| D. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 |
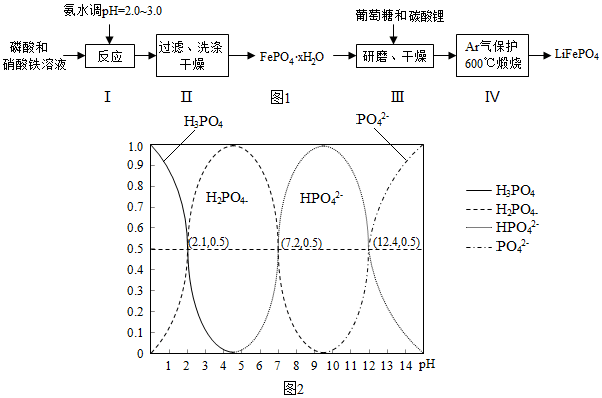
已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | 反应物和生成物的浓度都保持不变 | D. | 正反应和逆反应不再进行 |