题目内容
13.以下实验能获得成功的是( )| A. | 用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3 | |
| B. | 将铁屑、溴水、苯混合制溴苯 | |
| C. | 检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 | |
| D. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 |
分析 A.乙烯和丙烯都能够时酸性高锰酸钾溶液褪色;
B.苯不与溴水反应;
C.水解后溶液中应该先加碱至碱性,再检验葡萄糖;
D.铜丝在酒精灯上加热后,生成CuO具有氧化性,可氧化乙醇.
解答 解:A.乙烯和CH2=CH-CH3都含有碳碳双键,二者与酸性高锰酸钾溶液的反应现象相同,无法用酸性KMnO4溶液鉴别乙烯和CH2=CH-CH3,故A错误;
B.制取溴苯应该用液溴,苯不与溴水反应,故B错误;
C.水解后先加碱至碱性,再检验葡萄糖,则取1mL 20%的蔗糖溶液,加3~5滴稀硫酸.水浴加热5min后取少量溶液,应该先加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,否则稀硫酸与银氨溶液反应,干扰了实验结果,故C错误;
D.铜丝在酒精灯上加热后,生成CuO具有氧化性,可氧化乙醇,铜丝恢复成原来的红色,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及混物质制备、检验、鉴别等,侧重物质性质及实验操作细节的考查,选项C为易错点,注意方案的合理性、操作性分析,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.化合物L是一种能使人及动物的内分泌系统发生所能紊乱导致生育及繁殖异常的环境激素,它在一定条 件下水解可生成双酚A和有机酸M.下列关于L、双酚A和M的叙述中正确的是( )

| A. | 1mol L分别与足量NaOH和H2反应,最多可消耗2mol NaOH和8mol H2 | |
| B. | 双酚A与苯酚互为同系物 | |
| C. | 与有机酸M含相同官能团的同分异构体还有2种 | |
| D. | 化合物L、双酚A和有机酸M 均能与溴水发生加成反应 |
1.下列各化合物的命名正确的是( )
| A. | C(CH3)4 1,1,2,2-四甲基甲烷 | |
| B. |  1,3,4-三甲苯 1,3,4-三甲苯 | |
| C. | CH3CH2CH(OH)CH3 2-丁醇 | |
| D. | CH3CH2CH2Br 溴丙烷 |
8.在实验或生活中为了控制反应速率,下列做法不正确的是( )
| A. | 用氯酸钾制取氧气时可加入少量的高锰酸钾以加快反应速率 | |
| B. | 为加快制取氢气的速率用锌粉代替锌粒 | |
| C. | 为降低HNO3与Cu反应制备NO2的速率可以采用稀硝酸代替浓硝酸 | |
| D. | 为了延长食品的保质期在食品包装袋中加入硅胶、硫酸亚铁 |
18. 我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )
我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )
 我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )
我国科学工作者合成了许多结构复杂的天然有机化合物,如叶绿素、血红素、维生素B12等.叶绿素的结构如图.下列有关说法中正确的是( )| A. | 叶绿素属于高分子化合物 | |
| B. | 在一定条件下,叶绿素能发生加成、水解、酯化等反应 | |
| C. | 叶绿素分子中含有两种类型的双键 | |
| D. | 叶绿素中Mg2+与四个N之间结合方式不完全相同 |
5.如图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )


| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
3.锂离子电池是目前具有最高比能量的二次电池.LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择.生产LiFePO4的一种工艺流程如图1:
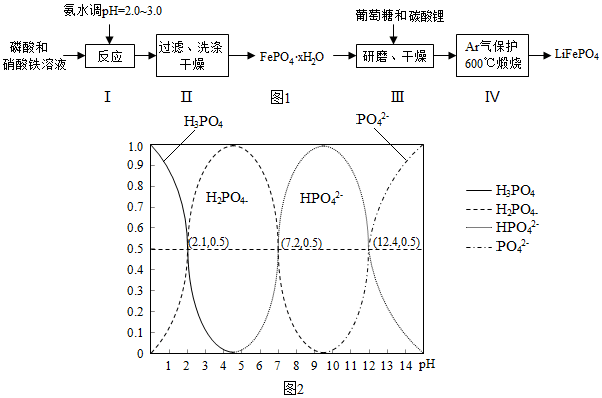
已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
固体失重质量分数=(样品起始质量-剩余固体质量)/样品起始质量100%,则x=2.1(保留至0.1).
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.

已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.