题目内容
15.氢氧燃料电池以氢气为燃料,氧气为氧化剂,电极是多孔镍电极,电解质溶液为质量分数30%的KOH溶液,有关叙述正确的是( )①负极反应式为2H2-4e-═4H+②负极反应式为2H2+4OH--4e-═4H2O
③工作时正极pH增大,而负极pH减小 ④工作时负极pH增大,而正极pH减小
⑤工作时溶液中阴离子移向正极 ⑥使用一段时间,KOH溶液质量分数仍为30%
| A. | ①②③ | B. | ②③ | C. | ②③⑥ | D. | ④⑤ |
分析 氢氧燃料电池是将化学能转变为电能的装置,工作时,通入氢气的一极为电池的负极,发生氧化反应,通入氧气的一极为电池的正极,发生还原反应,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水.
解答 解:①在燃料电池中,通入燃料氢气的一极为电池的负极,电极反应为H2+2OH--2e-=2H2O,故错误;
②在燃料电池中,通入燃料氢气的一极为电池的负极,电极反应为H2+2OH--2e-=2H2O,故正确;
③在燃料电池中,通入燃料氢气的一极为电池的负极,负极上消耗氢氧根离子,所以负极区pH降低,正极区生成氢氧根离子,所以pH升高,故正确;
④工作时负极上消耗氢氧根离子,所以负极区pH降低,正极区生成氢氧根离子,所以pH升高,故错误;
⑤原电池中,溶液中阴离子移向负极,故错误;
⑥使用一段时间,由于燃料电池产生水,所以KOH溶液质量分数会小于30%,故错误.
故选B.
点评 本题考查学生原电池的工作原理以及电极反应方程式的书写知识,属于基本知识的考查,难度不大.

练习册系列答案
相关题目
5.如图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误的是( )


| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
6.下列有关物质的性质与用途具有对应关系的是( )
| A. | 油脂能在碱性条件下水解,可用于工业上制取肥皂 | |
| B. | 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘 | |
| C. | 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂 | |
| D. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 |
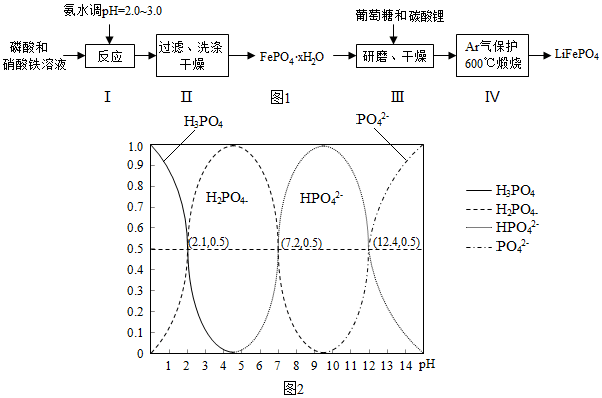
3.锂离子电池是目前具有最高比能量的二次电池.LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择.生产LiFePO4的一种工艺流程如图1:
已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
固体失重质量分数=(样品起始质量-剩余固体质量)/样品起始质量100%,则x=2.1(保留至0.1).
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.

已知Kap:(FePO4•xH2O)=1.0×10-15,Kap[Fe(OH)3]=4.0×10-30
回答下列问题:
(1)在合成硝酸铁时,步骤I中pH的控制是关键.如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是生成Fe(OH)3杂质,影响磷酸铁的纯度.
(2)步骤II中,洗涤是为了除去FePO4•xH2O表面附着的NO3-、NH4+、H+等离子
(3)取3组FePO4•xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如表:
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
(4)步骤III中研磨的作用是使反应物混合均匀,增大反应速率,提高反应产率.
(5)在步骤IV中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为24:1.
(6)H3PO4是三元酸,图2是溶液中含磷微粒的物质的量分数(δ)随pH变化示意图.则PO42-第一步水解的水解常数K1的表达式为$\frac{c(O{H}^{-})c(HP{{O}_{4}}^{2-})}{c(P{{O}_{4}}^{3-})}$,K1的数值最接近B (填字母).
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2.
10. 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )
 某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )
某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图象如图所示,下列说法不正确的是( )| A. | 原溶液中一定含有的阳离子是H+、NH4+、Fe3+、Al3+ | |
| B. | 原溶液中一定含有SO42- | |
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | |
| D. | 反应最后形成的溶液中溶质为Na2SO4 |
20.分别将下列各物质等体积混合,在室温下剧烈振荡,静置后能形成均匀溶液的是( )
| A. | 乙酸乙酯 水 | B. | 苯 水 | C. | 乙醇 水 | D. | 四氯化碳 碘水 |
7.已知反应式:①H2S+I2=S↓+2H++2I-②H2SO3+2H2S=3S↓+3H2O ③2I-+Br2=I2+2Br-④H2SO3+I2+H2O=SO42-+2I-+4H+,下列各组中还原性由弱到强的是( )
| A. | H2S、H2SO3、I-、Br- | B. | I-、Br-、H2SO3、H2S | ||
| C. | Br-、I-、H2SO3、H2S | D. | I-、Br-、H2S、H2SO3 |
4.对于可逆反应M+N?Q达到平衡时,下列说法正确的是( )
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | 反应物和生成物的浓度都保持不变 | D. | 正反应和逆反应不再进行 |
 二氧化碳:
二氧化碳: 过氧化钠:
过氧化钠: .
.