题目内容
Ⅰ.①微粒AXn-核外有18个电子,则它的核电荷数为 ,核内中子数为 ;②由1H216O与
2H217O所代表的物质中,共有 种元素, 种原子.
Ⅱ.有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数.
①写出A的原子结构示意图 ;元素C的原子核组成符号 .
②B的阴离子结构示意图 ;A、B组成的化合物的化学式 .
2H217O所代表的物质中,共有
Ⅱ.有A、B、C三种元素,已知A元素原子的K层和M层电子数相同;B元素原子的L层比K层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数.
①写出A的原子结构示意图
②B的阴离子结构示意图
考点:质量数与质子数、中子数之间的相互关系,原子结构示意图
专题:原子组成与结构专题
分析:Ⅰ.①阴离子的核电荷数=核内质子数=核外电子数-电荷数,中子数=质量数-质子数;
②元素是具有相同核电荷数的一类原子,核素是具有一定数目的质子和一定数目的中子的一种原子;
Ⅱ.A元素原子的K层和M层电子数相同,说明A有12个电子,则A为Mg;B元素原子的L层比K层电子数多5个,说明B有9个电子,则B为F;C元素的+3价阳离子和氖原子具有相同的电子数,则C有13个电子,C为Al;据此分析即可.
②元素是具有相同核电荷数的一类原子,核素是具有一定数目的质子和一定数目的中子的一种原子;
Ⅱ.A元素原子的K层和M层电子数相同,说明A有12个电子,则A为Mg;B元素原子的L层比K层电子数多5个,说明B有9个电子,则B为F;C元素的+3价阳离子和氖原子具有相同的电子数,则C有13个电子,C为Al;据此分析即可.
解答:
解:Ⅰ.①阴离子的核电荷数=核内质子数=核外电子数-电荷数=18-n;
中子数=质量数-质子数=质量数-(核外电子数-电荷数)=A-(18-n )=A-18+n;
故答案为:18-n; A-18+n.
②元素是具有相同核电荷数的一类原子,所以有2种元素;核素是具有一定数目的质子和一定数目的中子的一种原子,所以有4种核素,即有4种原子.
故答案为:2; 4;
Ⅱ.A元素原子的K层和M层电子数相同,说明A有12个电子,则A为Mg;B元素原子的L层比K层电子数多5个,说明B有9个电子,则B为F;C元素的+3价阳离子和氖原子具有相同的电子数,则C有13个电子,C为Al;
①已知A为Mg,其核外有3个电子层,其原子结构示意图为: ;元素C为Al,其质量数为27,核内有13个质子,则Al的原子核组成符号为:
;元素C为Al,其质量数为27,核内有13个质子,则Al的原子核组成符号为:
Al;
故答案为: ;
;
Al;
②已知B为F元素,F的阴离子核外有10个电子,其离子结构示意图为: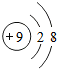 ;A、B组成的化合物的化学式为MgF2;
;A、B组成的化合物的化学式为MgF2;
故答案为: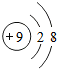 ;MgF2.
;MgF2.
中子数=质量数-质子数=质量数-(核外电子数-电荷数)=A-(18-n )=A-18+n;
故答案为:18-n; A-18+n.
②元素是具有相同核电荷数的一类原子,所以有2种元素;核素是具有一定数目的质子和一定数目的中子的一种原子,所以有4种核素,即有4种原子.
故答案为:2; 4;
Ⅱ.A元素原子的K层和M层电子数相同,说明A有12个电子,则A为Mg;B元素原子的L层比K层电子数多5个,说明B有9个电子,则B为F;C元素的+3价阳离子和氖原子具有相同的电子数,则C有13个电子,C为Al;
①已知A为Mg,其核外有3个电子层,其原子结构示意图为:
 ;元素C为Al,其质量数为27,核内有13个质子,则Al的原子核组成符号为:
;元素C为Al,其质量数为27,核内有13个质子,则Al的原子核组成符号为:27 13 |
故答案为:
 ;
;27 13 |
②已知B为F元素,F的阴离子核外有10个电子,其离子结构示意图为:
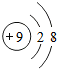 ;A、B组成的化合物的化学式为MgF2;
;A、B组成的化合物的化学式为MgF2;故答案为:
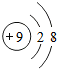 ;MgF2.
;MgF2.
点评:本题考查了原子能微粒间的相互关系、核外电子排布、元素的推断等,题目难度不大,侧重于基础知识的考查.

练习册系列答案
相关题目
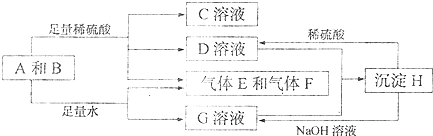
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: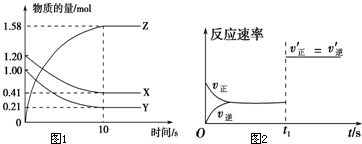 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图1所示: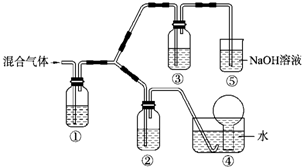 (一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(一)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题: