题目内容
(普通班做)
(1)某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,则烃A的分子式是 .
(2)标准状况下,5.6L甲烷和乙烯的混合气体,通过足量的溴水,使溴水的质量增加了4.2g,求混合气体中甲烷的质量.
(1)某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol,则烃A的分子式是
(2)标准状况下,5.6L甲烷和乙烯的混合气体,通过足量的溴水,使溴水的质量增加了4.2g,求混合气体中甲烷的质量.
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,则根据原子守恒可以确定分子式;
(2)甲烷不与溴水反应,乙烯能与溴水反应生成二溴乙烷,说明乙烯的质量为4.2 g,根据n=
计算混合气体总的物质的量,根据n=
计算乙烯的物质的量,进而计算甲烷的物质的量,再根据m=nM计算甲烷的质量.
(2)甲烷不与溴水反应,乙烯能与溴水反应生成二溴乙烷,说明乙烯的质量为4.2 g,根据n=
| V |
| Vm |
| m |
| M |
解答:
解:(1)烃含有C、H两种元素,某烃A0.2mol在氧气的充分燃烧后生成化合物B,C各1.2mol,即生成CO2、H2O各1.2mol,所以碳原子和氢原子的个数分别为:
=6、
=12,所以烃A的分子式为C6H12,
故答案为:C6H12;
(2)甲烷不与溴水反应,乙烯能与溴水反应生成二溴乙烷,说明乙烯的质量为4.2 g,故乙烯的物质的量=
=0.15mol,混合气体总的物质的量=
=0.25mol,故甲烷的物质的量为0.25mol-0.15mol=0.1mol,则甲烷的质量为:0.1mol×16g/mol=1.6g,
答:混合气体中甲烷的质量为1.6g.
| 1.2mol |
| 0.2mol |
| 1.2mol×2 |
| 0.2mol |
故答案为:C6H12;
(2)甲烷不与溴水反应,乙烯能与溴水反应生成二溴乙烷,说明乙烯的质量为4.2 g,故乙烯的物质的量=
| 4.2g |
| 28g/mol |
| 5.6L |
| 22.4L/mol |
答:混合气体中甲烷的质量为1.6g.
点评:本题考查了混合物的计算,题目难度中等,注意掌握有机物分子式的确定方法,(2)为易错点,注意乙烯与甲烷的性质的差异性,确定溴水增重为乙烯的质量是解题关键.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
下列对有关元素的叙述能说明该元素一定是主族元素的是( )
| A、原子核外M层有8个电子的元素 |
| B、原子核外L层比M层多一个电子的元素 |
| C、最高价为+7价的元素 |
| D、原子最外层电子数为2的元素 |
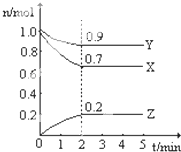 I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
I、某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.