题目内容
3.用铁片与稀硫酸反应制备氢气时,下列措施 ①加水、②不用稀硫酸,改用98%浓硫酸、③加热、④加CuSO4溶液,能使氢气生成速率加大的是( )| A. | ②④ | B. | ③④ | C. | ②③④ | D. | ①②③ |
分析 增大反应速率可增大浓度、升高温度或增大固体的表面积,也可形成原电池反应,注意不能用浓硫酸,以此解答.
解答 解:①加水,溶液体积增大,浓度减小,反应速率减小,故错误;
②改用98%的浓硫酸,铁在室温下与浓硫酸发生钝化反应,不能加快生成氢气的反应速率,故错误;
③温度升高,活化分子的百分数增大,反应速率增大,故正确;
④加CuSO4溶液,铁置换出铜,形成原电池反应,加快反应速率,故正确.
故选B.
点评 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.实验室制取下列气体,可用同一气体发生装置,并用相同收集方法的一组是( )
| A. | SO2和O2 | B. | H2和HCl | C. | H2S和HCl | D. | Cl2和HCl |
18.下列说法错误的是( )
| A. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 | |
| B. | 硬脂酸甘油酯和油酸甘油酯互为同系物 | |
| C. | 三硝基甲苯的分子式为C7H5N3O6 | |
| D. | 淀粉与纤维素的化学式为(C6H10O5)n,但两者不是同分异构体 |
8.为了探究氯水的成分,现实验如表:
(1)实验①得出的结论氯水中含有Cl-.
(2)指出实验②和实验③中的“实验现象”:
②有色布条褪色;③有气泡生成
(3)实验②的“实验现象”,同学们得出两个不同的结论.这两个结论可能是
a.Cl2具有漂白性,b.HClO具有漂白性.
请设计简单的实验证明哪一个是正确的用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①③实验无影响.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
(2)指出实验②和实验③中的“实验现象”:
②有色布条褪色;③有气泡生成
(3)实验②的“实验现象”,同学们得出两个不同的结论.这两个结论可能是
a.Cl2具有漂白性,b.HClO具有漂白性.
请设计简单的实验证明哪一个是正确的用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①③实验无影响.
15.已知由锌、铜、硫酸铜溶液构成的原电池,下列说法正确的是( )
| A. | 该原电池的正极是锌 | B. | 铜电极发生还原反应 | ||
| C. | 原电池中Cu2+向锌极移动 | D. | 铜极有气体放出 |
12.一定条件下,乙醛可发生分解:CH3CHO(l)→CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:( )
反应Ⅰ:CH3CHO+I2→CH3I2+HI+CO
反应Ⅱ:CH3I+HI→CH4+I2 .
反应Ⅰ:CH3CHO+I2→CH3I2+HI+CO
反应Ⅱ:CH3I+HI→CH4+I2 .
| A. | 反应速率与I2的浓度有关 | |
| B. | HI在反应Ⅰ中是氧化产物 | |
| C. | 反应焓变的绝对值等于190kJ•mol-1 | |
| D. | 乙醛的反应速率主要取决于反应Ⅱ |




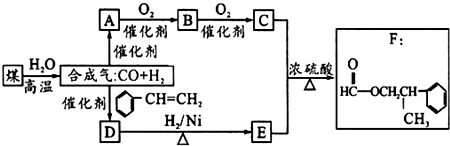
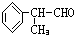
 .
. 、
、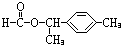 .
.