题目内容
6.将100mL 0.001mol•L-1的盐酸和50mL pH=3的硫酸溶液混合后,所得溶液的pH为( )| A. | 4.5 | B. | 2.7 | C. | 3.3 | D. | 3 |
分析 由于混合后溶液显酸性,故应根据氢离子浓度c(H+)=$\frac{n({H}^{+})_{1}+n({H}^{+})_{2}}{{V}_{酸1}+{V}_{酸2}}$计算出溶液的pH,据此分析.
解答 解:常温下,100mL0.001mol/L的盐酸和50mLpH=3的硫酸溶液混合后溶液中氢离子浓度为$\frac{0.1L×0.001mol/L+0.05L×0.001mol/L}{0.15L}$=10-3mol•L-1,混合溶液的pH为:pH=-lg10-3=3,故选D.
点评 本题考查酸酸混合pH的计算,明确浓度与pH的换算是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
8.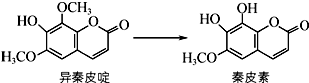 异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )
异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )
 异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )
异秦皮啶具有抗肿瘤功效,秦皮素具有抗痢疾杆菌功效.它们在一定条件下可发生如图所示的转化.下列说法正确的是( )| A. | 异秦皮啶与秦皮素互为同系物 | |
| B. | 鉴别异秦皮啶与秦皮素可用溴水 | |
| C. | 1 mol秦皮素最多可与3 mol NaOH反应 | |
| D. | 每个异秦皮啶分子与氢气完全加成后的产物中含有5个手性碳原子 |
14.下列关于元素周期律的叙述正确的是( )
| A. | 随着元素原子序数的递增,原子最外层电子总是从1到8重复出现 | |
| B. | 随着元素原子序数的递增,原子半径从大到小(稀有气体除外)发生周期性变化 | |
| C. | 随着元素原子序数的递增,元素最高正价从+1到+7、负价从-7到-1重复出现 | |
| D. | 元素性质的周期性变化是指原子核外电子排布的周期性变化、原子半径的周期性变化 |
11.Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
18.下列反应属于氮的固定作用的是( )
| A. | N2和H2一定条件下反应制取NH3 | B. | 硝酸工厂用NH3氧化制取NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳酸氢铵和硫酸氨 |
15.某有机化合物的结构简式如图,对该有机化合物说法错误的是( )
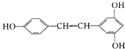

| A. | 是苯酚的同系物 | B. | 可发生加成、氧化、取代等反应 | ||
| C. | 所有原子可能共平面 | D. | 分子式为C14H12O3 |
16.下列晶体或分子中,含有化学键类型有差异的一组是( )
| A. | NH3、NO2 | B. | NaCl、KF | C. | NaOH、Ca(OH)2 | D. | MgO、H2O2 |
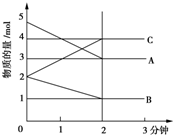 某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C.
某可逆反应在某体积为5L的密闭容器中进行,在从0~3分钟各物质的量的变化情况如图所示(A,B,C均为气体),该反应的化学方程式为2A+B?2C. D、H2 和D2
D、H2 和D2