题目内容
19.下列离子方程式书写不正确的是( )①铝溶于稀硫酸中:Al+2H+═Al3++H2↑
②将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑
③用食醋除去热水瓶中的水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O
④氯化钙与碳酸氢钾溶液反应:Ca2++CO32-═CaCO3↓
| A. | ①②③ | B. | ②③④ | C. | ①②④ | D. | ③ |
分析 ①电子、电荷不守恒;
②反应生成硫酸亚铁和氢气;
③反应生成醋酸钙、水、二氧化碳;
④二者不反应.
解答 解:①铝溶于稀硫酸中的离子反应为2Al+6H+═3Al3++3H2↑,故错误;
②将铁粉加入稀硫酸中的离子反应为Fe+2H+═Fe2++H2↑,故错误;
③用食醋除去热水瓶中的水垢的离子反应为CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故正确;
④氯化钙与碳酸氢钾溶液反应,不反应,则不能写离子反应,故错误;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
9.下列化合物的核磁共振氢谱中出现三组峰的是( )
| A. | 异戊烷 | B. | 异戊二烯 | C. | 邻二甲苯 | D. | 萘 |
10.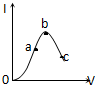 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示,下列叙述正确的是( )| A. | a、b、c三点处,溶液c(H+)由小到大的顺序为a、b、c | |
| B. | a、b、c三点处,电离程度最大的是b | |
| C. | a、b、c三点处,c(CH3COO-)最大的是c | |
| D. | 若使c点溶液中c(CH3COO-)增大,可采取的措施有加入NaOH固体或加热 |
7.下列有关实验的做法错误的是( )
| A. | 分液时,分液漏斗中的上层液体应由上口倒出 | |
| B. | 用NaOH固体配制100mL 1mol•L-1的氢氧化钠溶液时,用到的玻璃仪器主要有玻璃棒、烧杯、量筒、胶头滴管、100mL容量瓶 | |
| C. | 配制一定物质的量浓度溶液过程中,玻璃棒的作用主要是搅拌和引流 | |
| D. | 容量瓶在使用前要检查是否漏水,若瓶内残留蒸馏水会导致所得溶液浓度偏低 |
14.在标准状况下,112mL某气体的质量为0.16g,该气体可能是( )
| A. | O2 | B. | N2 | C. | H2S | D. | CO2 |
4.下列单体中,能在一定条件下发生加聚反应生成 的是( )
的是( )
 的是( )
的是( )| A. |  | B. |  | C. | 乙烯和 | D. |  |
11.某溶液由Mg2+、Al3+、Cl-、SO${\;}_{4}^{2-}$4种离子组成,测得其中Al3+、SO${\;}_{4}^{2-}$、Cl-的物质的量浓度之比为3:1:13,则溶液中Mg2+、Al3+、SO${\;}_{4}^{2-}$的物质的量浓度之比为( )
| A. | 1:3:3 | B. | 3:1:3 | C. | 3:3:1 | D. | 2:1:3 |
8.下列叙述正确的是( )
| A. | pH=2的硫酸溶液中c(H+):c(OH-)等于2:1,稀释100倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中:K+、Ba2+、Cl-、Br-、一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,若使pH=1的H2SO4溶液与pH=12的NaOH溶液混合后溶液呈中性,则两者的体积比为10:1 |