题目内容
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,104 g苯乙烯中含有的碳碳双键数为NA |
| B、5.6克铁与足量盐酸反应,转移0.3NA个电子 |
| C、2mol的甲基(-CH3)所含电子数为14NA |
| D、标准状况下,22.4L辛烷完全燃烧生成二氧化碳分子数为8NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、1mol苯乙烯中含1mol碳碳双键;
B、铁与稀盐酸反应转化为+2价;
C、甲基不显电性;
D、标况下,辛烷为液态.
B、铁与稀盐酸反应转化为+2价;
C、甲基不显电性;
D、标况下,辛烷为液态.
解答:
解:A、104g苯乙烯的物质的量为1mol,由于苯环不是单双键交替结构,故1mol苯乙烯中含1mol碳碳双键,故A正确;
B、5.6g铁的物质的量为0.1mol,而铁与稀盐酸反应转化为+2价,故0.1mol铁转移0.2mol电子,故B错误;
C、甲基不显电性,故1mol甲基含9mol电子,故C错误;
D、标况下,辛烷为液态,故D错误.
故选A.
B、5.6g铁的物质的量为0.1mol,而铁与稀盐酸反应转化为+2价,故0.1mol铁转移0.2mol电子,故B错误;
C、甲基不显电性,故1mol甲基含9mol电子,故C错误;
D、标况下,辛烷为液态,故D错误.
故选A.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
下列说法不正确的是( )
| A、在人类研究物质微观结构的过程中,先后使用了光学显微镜、电子显微镜、扫描隧道显微镜三种不同层次的观测仪器 |
| B、铝硅酸盐分子筛可用于物质分离,还可用作干燥剂、催化剂及催化剂载体 |
| C、使用可再生资源、提高原子经济性、推广利用二氧化碳与环氧丙烷生成的可降解高聚物等都是绿色化学的内容 |
| D、铁盐会水解产生具有吸附性的胶体粒子,可用于饮用水的杀菌消毒 |
下列有关安全措施不恰当的是( )
| A、实验室使用电器时,不能用湿手接触电器 |
| B、实验结束后,应关好水龙头、排气扇及切断电源 |
| C、未经老师允许,可以带食物进实验室,可以边做实验边吃东西 |
| D、酒精灯里的酒精不准带出实验室 |
下列关于乙烯的说法错误的是( )
| A、乙烯的化学性质比乙烷活泼 |
| B、收集乙烯可用排空气法 |
| C、可作香蕉等水果的催熟剂 |
| D、燃烧时火焰明亮,同时产生黑烟 |
用下列实验装置进行相应的实验,能达到实验目的是( )
A、 利用如图装置制取并收集干燥纯净的NH3 |
B、 利用如图所示装置制备可除去NO2中的NO |
C、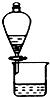 利用如图装置可分离CH3COOC2H5和饱和碳酸钠溶液 |
D、 利用如图装置制备Fe(OH)2并能较长时间观察其颜色 |
取一定质量的铜镁合金完全溶于一定体积的浓硝酸中,产生2240mL的NO2和1120mL的NO气体(标准状况下),在反应后的溶液中加足量的氢氧化钠溶液,生成的沉淀的质量可能为( )
| A、7g | B、10g |
| C、13g | D、16g |
设NA为阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、1molFe与稀硝酸完全反应,转移的电子数可以为2.5NA |
| B、标准状况下,22.4L甲醇所含的分子数目为NA |
| C、1molCnH2n+2所含的共用电子对数为(3n+1)NA |
| D、CO和H2混合物1mol,完全燃烧消耗O2的分子数为0.5 NA |
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.