题目内容
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.(1)第二周期中,第一电离能处于B与N之间的元素有
(2)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为
(3)乙烯酮(CH2=C=O)是一种重要的有机中间体,可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到.乙烯酮分子中碳原子杂化轨道类型有
(4)CH2=CHCN是制备晴纶的原料,其分子中σ键和π键的个数之比为
(5)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.每个碳原子周围与其距离最近的硅原子有
考点:元素电离能、电负性的含义及应用,原子核外电子排布,晶胞的计算,原子轨道杂化方式及杂化类型判断
专题:
分析:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(3)根据碳原子的价层电子对数判断杂化轨道类型;乙酸分子之间能形成氢键,而甲酸甲酯不能;
(4)共价单键为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,分子中C=C中的C不存在孤对电子,σ键数为3,C≡N中C不存在孤对电子,σ键数为2;
(5)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,以此解答.
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(3)根据碳原子的价层电子对数判断杂化轨道类型;乙酸分子之间能形成氢键,而甲酸甲酯不能;
(4)共价单键为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,分子中C=C中的C不存在孤对电子,σ键数为3,C≡N中C不存在孤对电子,σ键数为2;
(5)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,以此解答.
解答:
解:(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于相邻元素,根据电离能的变化规律,半充满的N原子和全充满的Be原子第一电离能要比同周期原子序数大的原子高,故第一电离能介于B、N之间的第二周期元素有Be、C、O三种元素,故答案为:3;
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2,故答案为:3d84s2;
(3)在CH2=C=O中,一个碳原子的价层电子对数为
=3,另一个碳原子的价层电子对数为
=2,所以碳原子的杂化轨道类型有sp2和sp,乙酸分子之间能形成氢键,而甲酸甲酯不能形成氢键,所以CH3COOH的沸点比HCOOCH3的高,故答案为:sp2和sp;CH3COOH能够形成分子间氢键,使沸点升高,HCOOCH3不能形成氢键;
(4)共价单键为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,CH2=CH-C≡N含6个σ键和3个π键,所以σ键和π键的个数之比为6:3=2:1,故答案为:2:1;
(5)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,故答案为:4.
(2)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2,故答案为:3d84s2;
(3)在CH2=C=O中,一个碳原子的价层电子对数为
| 4+2 |
| 2 |
| 4+0 |
| 2 |
(4)共价单键为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,CH2=CH-C≡N含6个σ键和3个π键,所以σ键和π键的个数之比为6:3=2:1,故答案为:2:1;
(5)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,故答案为:4.
点评:本题考查了杂化类型的判断、第一电离能、价层电子排布式、杂化轨道灯,注意把握同周期元素的第一电离能的变化趋势,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
在前一个分散系中慢慢地滴入后一种分散系所观察到的现象不是先沉淀后变澄清的是( )
| A、氢氧化铁胶体中滴加盐酸 |
| B、偏铝酸钠溶液中加盐酸 |
| C、氯化铝溶液中滴加氢氧化钠溶液 |
| D、氯化铝溶液中滴加氨水 |
用NA表示阿伏加德罗常数,下列叙述中正确的有几项( )
①78gNa2O2与足量的二氧化碳反应,转移电子数目为NA
②足量Fe与标况下22.4L的氯气反应转移电子数目为2NA
③常温常压下16gO2与O3混合气中含有氧原子数目为NA
④0.2mol/LNaOH 溶液中OH+的数目为0.2NA.
①78gNa2O2与足量的二氧化碳反应,转移电子数目为NA
②足量Fe与标况下22.4L的氯气反应转移电子数目为2NA
③常温常压下16gO2与O3混合气中含有氧原子数目为NA
④0.2mol/LNaOH 溶液中OH+的数目为0.2NA.
| A、1项 | B、2项 | C、3项 | D、4项 |
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A、2.3gNa与一定量氧气发生反应,钠无剩余,则转移电子数一定为0.1NA |
| B、常温常压下,100g17%H2O2水溶液中含氧原子总数为NA |
| C、常温常压下,2.24LN2气体分子中所含的共用电子对数目为0.3NA |
| D、5.6Fe分别足量氯气、盐酸反应,转移电子数都是0.2NA |
下列说法正确的是( )
| A、化学反应能够制造新物质,同时也能制造出新的元素 |
| B、煤在空气中强热得到焦炭、煤焦油、焦炉气、粗氨水等产物的过程叫煤的干馏 |
| C、在酿酒的过程中,葡萄糖可通过水解反应生成酒精 |
| D、工业生产玻璃、水泥、冶炼铁均需要用到石灰石为原料 |
短周期X、Y、Z、W的原子序数依次增大,其中X的阴离子的核外电子数与Y、Z原子的核外内层电子数相同,工业上采用液态空气分馏方法来生产Y的单质,Z元素无正价,W原子最外层电子数为其次外层电子的一半,根据以上叙述,下列说法正确的是( )
| A、Y、Z、W分别与X组成的化合物稳定性依次减弱 |
| B、W和Y形成的化合物可能与X与Z形成的化合物反应 |
| C、X与Y形成的化合物的水溶液一定呈碱性 |
| D、上述四种元素原子半径大小为X<Y<Z<W |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、常温常压下,104 g苯乙烯中含有的碳碳双键数为NA |
| B、5.6克铁与足量盐酸反应,转移0.3NA个电子 |
| C、2mol的甲基(-CH3)所含电子数为14NA |
| D、标准状况下,22.4L辛烷完全燃烧生成二氧化碳分子数为8NA |
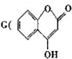 是一种合成多环化台物的中间体,可由下列路线合成(部分反应条件略去):
是一种合成多环化台物的中间体,可由下列路线合成(部分反应条件略去):


 )
)