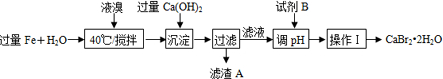
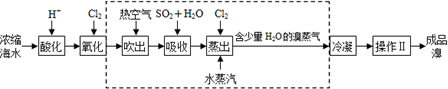
题目内容
5.一定温度下,10mL 0.4mol/L过氧化氢溶液在二氧化锰作用下发生分解,不同时刻测定生成O2的体积(已折算为标准状况)如表.| t/min | 0 | 2 | 4 | 6 | 8 |
| V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 |
(1)6min内过氧化氢的分解速率.(精确到0.01)
(2)6min内过氧化氢分解的转化率.
(3)6min内过氧化氢的物质的量浓度.
分析 过氧化氢分解反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2,
(1)根据n=$\frac{V}{{V}_{m}}$计算出6min内生成氧气的物质的量,然后根据方程式得出过氧化氢分解的物质的量,再根据v=$\frac{△n}{△t}$计算出6min内过氧化氢的分解速率;
(2)根据n=cV计算出过氧化钠的总物质的量,然后根据$\frac{分解的物质的量}{总物质的量}$×100%计算出过氧化氢的转化率;
(3)根据c=$\frac{n}{V}$计算出6min时过氧化氢的物质的量浓度.
解答 解:(1)标准状况下22.4L氧气的物质的量为:$\frac{22.4×1{0}^{-3}L}{22.4L/mol}$=0.001mol,根据反应2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2可知,生成0.001mol氧气需要消耗0.002mol过氧化氢,则过氧化氢的分解速率为:$\frac{\frac{0.002mol}{0.01L}}{6min}$=0.03mol/(L•min),
答:6min内过氧化氢的分解速率为0.03mol/(L•min);
(2)10mL 0.4mol/L过氧化氢溶液中含有过氧化氢的物质的量为:0.4mol/L×0.01L=0.004mol,
则6min内过氧化氢的分解转化率为:$\frac{0.002mol}{0.004mol}$×100%=50%,
答:6min内过氧化氢的分解转化率为50%;
(3)6min末过氧化氢的物质的量为:0.004mol-0.002mol=0.002mol,
则6min末过氧化氢的物质的量浓度为:$\frac{0.002mol}{0.01L}$=0.2mol/L,
答:6min末过氧化氢的物质的量浓度为0.2mol/L.
点评 本题考查了化学反应速率的计算,题目难度中等,涉及反应速率、分解转化率、物质的量浓度的计算,明确发生反应的实质为解答关键,注意掌握化学平衡及其影响因素,试题培养了学生的化学计算能力.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案| A. | 元素周期表有7个周期,8个主族 | |
| B. | 元素周期表有18个纵行,共16个族 | |
| C. | 短周期元素中可能有副族元素 | |
| D. | 最外层电子数相同的元素一定在同一族 |
| A. | 该溶液中Na+、Mg2+、AlO${\;}_{2}^{-}$、NO${\;}_{3}^{-}$可以大量共存 | |
| B. | 通入CO2气体产生白色沉淀 | |
| C. | 通入H2S气体无明显现象,原因是二者不反应 | |
| D. | 与少量Ba(OH)2溶液反应的离子方程式:Al3++2SO${\;}_{4}^{2-}$+2Ba2++3OH-=2BaSO4↓+Al(OH)3↓ |
 某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:
某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验. 查阅资料,有关信息如图:①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(2)装置C的作用为除去氯气中混有的H2O,减少三氯乙酸的生成;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,不能采取先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH的原因为CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中溶液为NaOH溶液,可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mol•L-1 Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理如下:CCl3CHO+OH-=CHCl3+HCOO-HCOO-+I2=H++2I-+CO2↑
I2+2S2O32-=2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1 mol•L-1,Ka (CH3COOH)=1.7×10-5 mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
分别测定0.1 mol•L-1两种酸溶液的pH,三氯乙酸的pH较小,证明三氯乙酸的酸性强于乙酸.
| A. | 需要加热才能发生的反应不一定是吸收热量的反应 | |
| B. | 科学家经常在金属与非金属的交界线处寻找良好的半导体材料 | |
| C. | 催化剂是影响化学反应速率和化学平衡的一个重要因素 | |
| D. | 物质燃烧可看做“储存”在物质内部的能量(化学能)转化为热能释放出来 |