题目内容
16.如图曲线表示F、Cl、Br元素及所形成物质的某种性质随核电荷数的变化趋势,正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A.卤族元素非金属性随着原子序数增大而减小,所以电负性随着原子序数增大而减小;
B.卤族元素氢化物稳定性依次减弱;
C.卤族元素钠盐熔点随着原子序数增大,离子键越来越弱;
D.卤族元素单质的熔点随着原子序数增大而增大.
解答 解:A.卤族元素元素非金属性越强其电负性越大,卤族元素非金属性随着原子序数增大而减小,所以电负性随着原子序数增大而减小,故A正确;
B.卤族元素氢化物分解温度降低,图象不符合,故B错误;
C.卤族元素中卤化钠中离子键越来越弱,熔点随着原子序数增大而减小,故C错误;
D.卤族元素单质的熔点随着原子序数增大而增大,故D错误;
故选A;
点评 本题考查了卤素元素性质的递变规律,题目难度不大,依据周期表中同主族元素性质的递变规律不难解答,易错选项为D,注意晶体沸点高低的规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列各组有机物的同分异构体种数相同的一组是( )
| A. | C4H10与C3H6 | B. | C5H12与C2H6O | C. | C2H2Cl4与CH2Cl2 | D. | CH2O与C2H4O2 |
4.向1L的密闭容器中加入1mol X、0.3mol Z和一定量的Y三种气体.一定条件下发生反应,各物质的浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.下列说法不正确的是( )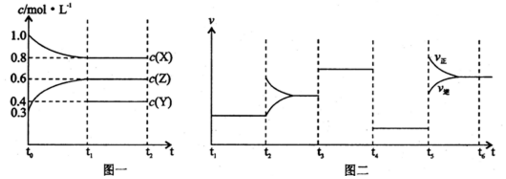

| A. | Y的起始物质的量为0.5 mol | |
| B. | 该反应的化学方程式为:2X(g)+Y(g)?3Z(g)△H<0 | |
| C. | 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s) | |
| D. | 反应物X的转化率t6点比t3点高 |
11.下列说法与盐类水解无关的是( )
| A. | 粗盐在空气中易潮解 | B. | NH4Cl与ZnCl2用于金属焊接中除锈 | ||
| C. | 用热纯碱溶液去油污 | D. | 蒸干并灼烧FeCl3溶液得到Fe2O3 |
1.如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是( )
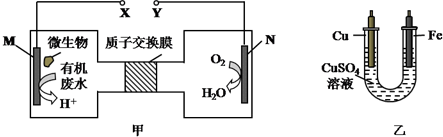

| A. | 乙装置中溶液颜色会变浅 | |
| B. | 铁电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25mol气体时,则铜电极质量减少16g |
7.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得溶液中加入0.1mol Cu2(OH)2CO3,溶液恰好恢复到电解前的浓度和pH(不考虑溶液体积变化和CO2溶解造成的影响),则电解过程中转移的电子为( )
| A. | 0.4mol | B. | 0.5mol | C. | 0.6mol | D. | 0.8mol |
4.短周期元素W、X、Y、Z的原子序数依次增大.W的单质与H2在暗处能化合并发生爆炸,X是同周期中金属性最强的元素,Y原子的最外层电子数等于电子层数,W和Z原子的最外层电子数相同.下列说法错误的是( )
| A. | 单质的沸点:Z>W | |
| B. | 简单离子半径:X>W | |
| C. | 元素X与氧可形成既含离子键也含非极性共价键的化合物 | |
| D. | X、Y、Z的最高价氧化物对应的水化物能相互反应 |
5.磁流体是电子材料的新秀.将含等物质的量的FeSO4和Fe2(SO4)3的溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径在36~55nm的磁流体.下列说法中正确的是( )
| A. | 所得的分散系属于悬浊液 | |
| B. | 用光束照射该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中分散质为Fe2O3 | |
| D. | 分散系为胶体,胶粒直径即Fe(OH)3分子直径 |
