题目内容
4.向1L的密闭容器中加入1mol X、0.3mol Z和一定量的Y三种气体.一定条件下发生反应,各物质的浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.下列说法不正确的是( )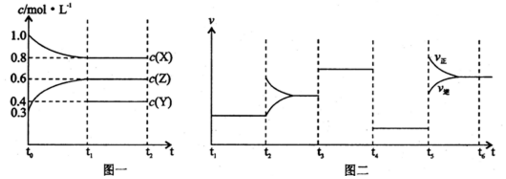
| A. | Y的起始物质的量为0.5 mol | |
| B. | 该反应的化学方程式为:2X(g)+Y(g)?3Z(g)△H<0 | |
| C. | 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L•s) | |
| D. | 反应物X的转化率t6点比t3点高 |
分析 t3~t4阶段与t4~t5阶段正逆反应速率都相等,判断t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;t2~t3为改变浓度的条件,t5~t6为升高温度,反应中X的浓度变化为1mol/L-0.8mol/L=0.2mol/L,Z的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则X、Z的化学计量数之比为2:3,该反应为气体体积不变的反应,则Y为反应物,该反应为2X(g)+Y(g)?3Z(g),以此来解答.
解答 解:t3~t4阶段与t4~t5阶段正逆反应速率都相等,判断t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中X的浓度变化为1mol/L-0.8mol/L=0.2mol/L,Z的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则X、Z的化学计量数之比为2:3,该反应为气体体积不变的反应,则Y为反应物,该反应为2X(g)+Y(g)?3Z(g),
A.X减少0.2mol/L,则Y减少0.1mol/L,则起始Y的浓度为0.4mol/L+0.1mol/L=0.5mol/L,起始物质的量为0.5mol/L×1L=0.5mol,故A正确;
B.上述计算得到化学方程式为:2X(g)+Y(g)?3Z(g),图象分析可知升温平衡正向进行说明正反应为吸热反应,故B错误;
C.若t0=0,t1=10 s,Z的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则t0~t1阶段的平均反应速率为v(Z)=$\frac{0.3mol/L}{10s}$=0.03 mol/(L•s),故C正确;
D.分析可知t5~t6为升高温度,平衡正向进行,反应物X的转化率t6点比t3点高,故D正确;
故选B.
点评 本题考查了化学平衡影响因素、图象分析判断、化学方程式书写,反应速率计算等,掌握基础是解题关键,题目难度中等.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案| A. | 相对原子质量 | B. | 近似相对原子质量 | ||
| C. | 某种同位素质量数 | D. | 某种同位素质子数 |
| A. | 正极 | B. | 负极 | C. | 阳极 | D. | 阴极 |
| A. | 0.01mol/L 标准盐酸溶液滴定未知浓度氨水,可以使用甲基橙作指示剂 | |
| B. | 向0.01mol/L酸性高锰酸钾溶液中滴加适量0.1mol/L草酸溶液,振荡,一段时间后溶液突然变为无色 | |
| C. | 向1mol/L KI溶液中逐滴滴加适量0.1mol/L稀硫酸和淀粉溶液,振荡,一段时间后无明显现象 | |
| D. | 向1mL 0.1mol/L MgCl2溶液的试管中滴加1~2滴2mol/L NaOH溶液,振荡后出现白色沉淀,再滴加2滴0.1mol/L FeCl3溶液,沉淀变为红褐色 |
| A. | 用排水法收集铜粉与浓硝酸反应产生的NO2 | |
| B. | 用氨水鉴别NaCl、MgCl2、AlCl3、NH4Cl四种溶液 | |
| C. | 用酸性KMnO4溶液验证草酸的还原性 | |
| D. | 用饱和NaHCO3溶液除去Cl2中混有的HCl |
| A. | Ne和Na+的结构示意图均为  | B. | 聚氯乙烯的结构简式为 | ||
| C. | 二氧化碳分子的比例模型: | D. | NH4Br的电子式 |
| A. | 溶液的导电性 | B. | 醋酸的电离常数 | ||
| C. | 完全中和时所需NaOH的量 | D. | H+的物质的量 |




