题目内容
某化学研究小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素 的质量分数,在实验室中按以下步骤进行实验:
的质量分数,在实验室中按以下步骤进行实验:
①称取a g样品;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL所配溶液,置于烧杯中;
④加入适量的氯水,使反应完全;
⑤加入过量氨水,充分搅拌;
⑥过滤,洗涤沉淀,并将其转移至坩埚中;
⑦加热并搅拌沉淀,至沉淀由红褐色全部变为红棕色,冷却后称量;
⑧重复步骤⑦的操作,直至合格为止.
请根据上面的叙述回答下列问题:
(1)如图所给仪器中,实验步骤①②③中必须用到的仪器是E和 (填仪器序号).
(2)步骤②加入盐酸的目的是 ;
(3)实验步骤⑤所得沉淀为 ;步骤⑥洗涤沉淀的方法是 ;
(4)步骤⑧合格的标准是
(5)若坩埚的质量是W1g,最终坩埚和固体的总质量是W2g,则样品中铁元素的质量分数为 ;
(6)指导教师认为步骤①~⑧中有一个步骤是多余的,这个步骤是 填序号).
 的质量分数,在实验室中按以下步骤进行实验:
的质量分数,在实验室中按以下步骤进行实验:①称取a g样品;
②取适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL所配溶液,置于烧杯中;
④加入适量的氯水,使反应完全;
⑤加入过量氨水,充分搅拌;
⑥过滤,洗涤沉淀,并将其转移至坩埚中;
⑦加热并搅拌沉淀,至沉淀由红褐色全部变为红棕色,冷却后称量;
⑧重复步骤⑦的操作,直至合格为止.
请根据上面的叙述回答下列问题:
(1)如图所给仪器中,实验步骤①②③中必须用到的仪器是E和
(2)步骤②加入盐酸的目的是
(3)实验步骤⑤所得沉淀为
(4)步骤⑧合格的标准是
(5)若坩埚的质量是W1g,最终坩埚和固体的总质量是W2g,则样品中铁元素的质量分数为
(6)指导教师认为步骤①~⑧中有一个步骤是多余的,这个步骤是
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)根据称量、溶解、配制一定物质的量浓度的溶液、准确量取溶液等操作确定所需仪器;
(2)FeCl3和FeCl2都是强酸弱碱盐,溶解过程中要发生水解;
(3)④加入适量的氯水,亚铁氧化成铁离子;⑤加入过量氨水,与铁离子反应生成氢氧化铁;
(4)加热氢氧化铁分解质量会减小,连续两次称量的质量相同时,则氢氧化铁完全分解;
(5)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g.氧化铁中铁元素的质量等于样品中铁元素的质量,进而计算铁元素的质量分数;
(6)因为⑦加热并搅拌沉淀,沉淀与空气直接接触,氢氧化亚铁也被氧化成氢氧化铁.
(2)FeCl3和FeCl2都是强酸弱碱盐,溶解过程中要发生水解;
(3)④加入适量的氯水,亚铁氧化成铁离子;⑤加入过量氨水,与铁离子反应生成氢氧化铁;
(4)加热氢氧化铁分解质量会减小,连续两次称量的质量相同时,则氢氧化铁完全分解;
(5)氢氧化铁加热灼烧后生成氧化铁,坩埚质量是W1,坩埚与加热后固体总质量是W2,则氧化铁的质量为(W2-W1)g.氧化铁中铁元素的质量等于样品中铁元素的质量,进而计算铁元素的质量分数;
(6)因为⑦加热并搅拌沉淀,沉淀与空气直接接触,氢氧化亚铁也被氧化成氢氧化铁.
解答:
解:(1)称量时需要天平、钥匙;溶解时需要烧杯、玻璃棒;配制一定物质的量浓度的溶液时需要量筒、烧杯、玻璃棒、胶头滴管、一定规格的容量瓶;准确量取溶液需要酸式滴定管、洗耳球,
故答案为:ABFG;
(2)FeCl3和FeCl2都是强酸弱碱盐,溶解过程中要发生水解,所以加盐酸防止FeCl3和FeCl2水解,故答案为:防止FeCl3和FeCl2水解;
(3))④加入适量的氯水,亚铁氧化成铁离子;⑤加入过量氨水,与铁离子反应生成氢氧化铁,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3+3NH4+,步骤⑥洗涤沉淀的方法是向漏斗里注入蒸馏水,使水面没过滤渣,水自然流完后,重复操作2~3次,
故答案为:Fe(OH)3;向漏斗里注入蒸馏水,使水面没过滤渣,水自然流完后,重复操作2~3次;
(4)加热氢氧化铁分解质量会减小,连续两次称量的质量相同时,则氢氧化铁完全分解,故答案为:连续两次称量质量相差小于0.1g;
(5)铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×
,样品中铁元素的质量(W2-W1)g×
×
=7(W2-W1)g,样品中铁元素的质量分数
×100%=
,
故答案为:
;
(6)因为⑦加热并搅拌沉淀,沉淀与空气直接接触,氢氧化亚铁也被氧化成氢氧化铁,所以第④步加入适量的氯水,氧化亚铁离子多余,故答案为:④.
故答案为:ABFG;
(2)FeCl3和FeCl2都是强酸弱碱盐,溶解过程中要发生水解,所以加盐酸防止FeCl3和FeCl2水解,故答案为:防止FeCl3和FeCl2水解;
(3))④加入适量的氯水,亚铁氧化成铁离子;⑤加入过量氨水,与铁离子反应生成氢氧化铁,反应的离子方程式为:Fe3++3NH3?H2O=Fe(OH)3+3NH4+,步骤⑥洗涤沉淀的方法是向漏斗里注入蒸馏水,使水面没过滤渣,水自然流完后,重复操作2~3次,
故答案为:Fe(OH)3;向漏斗里注入蒸馏水,使水面没过滤渣,水自然流完后,重复操作2~3次;
(4)加热氢氧化铁分解质量会减小,连续两次称量的质量相同时,则氢氧化铁完全分解,故答案为:连续两次称量质量相差小于0.1g;
(5)铁元素质量守恒,即红棕色固体中的铁就是样品中铁,Fe2O3中铁元素的质量为(W2-W1)g×
| 112 |
| 160 |
| 112 |
| 160 |
| 250 |
| 25 |
| 7(W2-W1)g |
| ag |
| 7(W2-W1)g |
| ag |
故答案为:
| 7(W2-W1)g |
| ag |
(6)因为⑦加热并搅拌沉淀,沉淀与空气直接接触,氢氧化亚铁也被氧化成氢氧化铁,所以第④步加入适量的氯水,氧化亚铁离子多余,故答案为:④.
点评:本题主要考查溶液的配制、对实验原理理解、对实验操作的评价、物质含量的测定、化学计算等,难度中等,需要学生具备扎实的基础知识与分析问题、解决问题能力.

练习册系列答案
相关题目
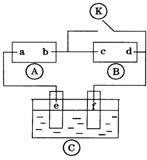 如图
如图 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀铜,接通
上的c点显红色.为实现铁上镀铜,接通 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )| A、a为直流电源的负极 |
| B、d极发生的反应为2H++2e-=H2↑ |
| C、f电极为铜板 |
| D、e极发生的反应为Cu-2e-=Cu2+ |
下列与化学反应能量变化相关的叙述正确的是( )
| A、水的电离是放热过程 |
| B、放热反应的反应速率是大于吸热反应的反应速率 |
| C、生成物总能量一定低于反应物的总能量 |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
下列各物质不是混合物的是( )
| A、黄铜 | B、水玻璃 |
| C、液氨 | D、漂白粉 |
下列判断中,正确的是( )
A、Na2CO3溶液中各离子浓度大小关系一定有c(Na+)>c(
| ||
| B、25℃时,Mg(OH)2固体在蒸馏水、盐酸和氯化铵溶液中的Kxp大小顺序为盐酸>氯化铵>蒸馏水 | ||
| C、已知25℃时NH4F显酸性,则25℃时的电离常数K(NH3?H2O)<K(HF) | ||
| D、AlCl3溶液和Al2(SO4)3溶液加热蒸干、灼烧都得到Al2O3 |
以下物质间的转化通过一步反应不能实现的是( )
①HCl→Cl2→HClO→NaClO
②Na→Na2O2→Na2CO3→NaHCO3
③Al→NaAlO2→Al(OH)3→Al2O3
④Si→SiO2→H2SiO3→Na2SiO3
⑤S→SO3→H2SO4→Na2SO4
⑥Cu→CuCl2→Cu(OH)2.
①HCl→Cl2→HClO→NaClO
②Na→Na2O2→Na2CO3→NaHCO3
③Al→NaAlO2→Al(OH)3→Al2O3
④Si→SiO2→H2SiO3→Na2SiO3
⑤S→SO3→H2SO4→Na2SO4
⑥Cu→CuCl2→Cu(OH)2.
| A、②③ | B、④⑤ |
| C、③④⑤⑥ | D、①④⑤ |
下列实验设计和结论的说法不正确的是( )
| A、将碘水倒入分液漏斗,加适量四氯化碳,振荡后静置,可将碘萃取到下层液体中 |
| B、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| C、加入盐酸以除去硫酸钠中的少量碳酸钠杂质 |
| D、在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,会得到含氢氧化铁的FeCl3溶液 |
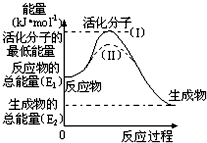 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ/mol表示.请认真观察图,然后回答问题.