题目内容
4.下列各组离子能在溶液中大量共存的是( )| A. | HCO3-、Na+、OH-、K+ | B. | CO32-、Ba2+、K+、NO3- | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | CO32-、Na+、NO3-、H+ |
分析 根据离子之间不能结合生成水、气体、沉淀等,则离子大量共存,以此来解答.
解答 解:A.HCO3-、OH-反应而不能大量共存,故A错误;
B.CO32-、Ba2+反应生成沉淀而不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.CO32-、H+反应生成二氧化碳和水而不能大量共存,故D错误.
故选C
点评 本题考查离子的共存,为高频考点,侧重复分解反应的考查,注意常见物质的溶解性、离子之间的反应即可解答,题目难度不大.

练习册系列答案
相关题目
15.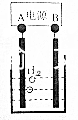 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
15.用铑的配合物作催化剂,一定条件下可直接光催化分解CO2发生反应:2CO2(g)═2CO(g)+O2(g).下列有关焓变与熵变说法不正确的是( )
| A. | 该反应的△S>0 | |
| B. | 该反应的△H<0 | |
| C. | 该反应的逆反应在一定条件下也能自发进行 | |
| D. | 该反应的熵变效应大于焓变效应 |
12.有aXn+ 和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )
| A. | b-a=n+m | B. | a-b=n-m | C. | 质子数Y>X | D. | 核电荷数Y<X |
16.下列说法全正确的是( )
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③碳原子数不同的直链烷烃一定是同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA(NA为阿伏伽德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
①CH3-CH=CH2和CH2=CH2的最简式相同
②CH≡CH和C6H6含碳量相同
③碳原子数不同的直链烷烃一定是同系物
④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2L的己烷所含的分子数为0.5NA(NA为阿伏伽德罗常数)
⑥能够快速、微量、精确的测定相对分子质量的物理方法是核磁共振氢谱法.
| A. | ①②③④ | B. | ②③④⑥ | C. | ②③⑥ | D. | ③⑤⑥ |
13.下列关于金属晶体的叙述正确的是( )
| A. | 用铂金做首饰不能用金属键理论解释 | |
| B. | 固态和熔融时易导电,熔点在1 000℃左右的晶体可能是金属晶体 | |
| C. | Li、Na、K的熔点逐渐升高 | |
| D. | 金属导电和熔融电解质(或电解质溶液)导电的原理一样 |
 ;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.
;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O. .
.