题目内容
14.现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子.请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);(1)A~F六种元素原子,原子半径最大的是Na(填元素符号),B元素在元素周期表中的位置第二周期第ⅤA族.
(2)A与C可形成化合物A2C2,该化合物的电子式为
 .
.(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(4)比较E、F气态氢化物的稳定性:HCl>H2S(用分子式表示).
分析 A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,化合物为水,则A为H元素,C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素.
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大;
(2)过氧化氢属于共价化合物,根据共价化合物电子式书写方法书写;
(3)考查浓硫酸与碳反应的方程式书写;
(4)非金属性越强,气态氢化物越稳定.
解答 解:A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A与C形成的化合物常温下为液态,化合物为水,则A为H元素,C为O元素;A、B的最外层电子数之和与C的最外层电子数相等,B的最外层电子数为5,则B为N元素;A、D同主族,则D为Na元素;C与E同主族,则E为S元素;D、E、F同周期,A能分别与E、F形成电子总数相等的气体分子,则F为Cl元素,即A为H元素,B为N元素;C为O元素,D为Na元素;E为S元素;F为Cl元素.
(1)同周期随原子序数增大,原子半径减小,最外层电子数相同,电子层越多原子半径越大,所以Na原子半径最大;B为N,位于第二周期第ⅤA族,故答案为:Na,第二周期第ⅤA族;
(2)A为H元素,C为O元素,A2C2为H2O2属于共价化合物,电子式为 ,
,
故答案为: ;
;
(3)A为H元素,C为O元素,E为S元素;三种元素形成的一种常见化合物,其浓溶液为浓硫酸,在加热条件下可与碳反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(4)非金属性Cl>S,则气态氢化物的稳定为HCl>H2S,故答案为:HCl>H2S.
点评 本题考查位置、结构、性质的关系及应用,综合性较强,考查知识点较多,元素的推断是解答本题的关键,A与C形成的化合物常温下为液态是推断突破口,并熟悉元素化合物的性质来解答,难度较大.

 名题金卷系列答案
名题金卷系列答案| A. | HCO3-、Na+、OH-、K+ | B. | CO32-、Ba2+、K+、NO3- | ||
| C. | Ba2+、OH-、Cl-、Na+ | D. | CO32-、Na+、NO3-、H+ |
| A. | 一定有乙烷 | B. | 一定有丙烷 | ||
| C. | 可能是乙烷和丙烷的混合物 | D. | 可能是甲烷和丁烷的混合物 |
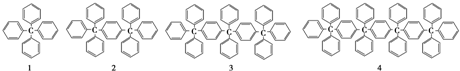
| A. | C158H118 | B. | C158H116 | C. | C160H116 | D. | C160H118 |
| A. | 氨气  | B. | 四氯化碳  | C. | 氮气  | D. | 过氧化氢  |
| A | C | |
| B |
| A. | A、B、C三元素的气态氢化物溶于水均显酸性 | |
| B. | A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同 | |
| C. | C在周期表中的位置为第二周期第ⅦA族,最高价为+7价 | |
| D. | B02是酸性氧化物,AO2不是酸性氧化物 |
| A. | 等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) | |
| B. | 乙烯与氯气反应(1,2-二氯乙烷) | |
| C. | 液溴与苯用溴化铁作催化剂反应(溴苯) | |
| D. | 乙烯与水反应(乙醇) |
 .
.