题目内容
10.下列关于NaHSO4的说法中正确的是( )| A. | NaHSO4固体是离子晶体 | |
| B. | NaHSO4晶体中阳离子和阴离子的个数是2:1 | |
| C. | NaHSO4晶体熔化时破坏的是离子键和共价键 | |
| D. | NaHSO4固体溶于水时既破坏离子键又破坏共价键 |
分析 NaHSO4含离子键、共价键,晶体由钠离子和硫酸氢根离子构成,溶于水电离出钠离子、氢离子、硫酸根离子,以此来解答.
解答 解:A.NaHSO4固体由离子构成,是离子晶体,故A正确;
B.NaHSO4晶体中阳离子和阴离子的个数是1:1,故B错误;
C.NaHSO4晶体熔化时电离出钠离子、硫酸氢根离子,破坏的是离子键,故C错误;
D.NaHSO4固体溶于水时电离出钠离子、氢离子、硫酸根离子,既破坏离子键又破坏共价键,故D正确;
故选AD.
点评 本题考查离子化合物及晶体,为高频考点,把握晶体的构成微粒、物质的电离为解答的关键,侧重分析与应用能力的考查,注意熔化与溶于水的电离不同,题目难度不大.

练习册系列答案
相关题目
1.下列有关叙述中正确的是( )
| A. | CH4与P4的分子结构都是正四面体形,闪此在6.02×1023个CH4分子或P4分子中都含布4×6.02×1023个 共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si一O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去 0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
18.已知:①向KMnO4晶体中滴加盐酸,产生黄绿色的气体;②向FeCl2溶液中通入少量的实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( )
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中发生的反应都是氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②可以证明Fe2+既有氧化性又有还原性 |
15.德班气候大会上,各国就减排承诺展开讨论.减排主要是指减少下列哪种气体的排放量( )
| A. | 二氧化碳 | B. | 二氧化硫 | C. | 氮氧化物 | D. | 氟氯烃 |
2.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和$\frac{1}{2}$O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| A. | 通H2的一极是正极,通O2的一极是负极 | |
| B. | 通O2的一极是正极,通H2的一极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作时负极区附近pH不变 |
19.水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO${\;}_{3}^{2-}$、SO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$中的若干种离子.某同学对该溶液进行了如下实验:
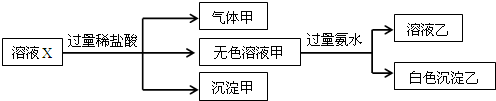
下列判断正确的是( )

下列判断正确的是( )
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸铝的混合物 | |
| C. | 所有阴离子都可能存在于溶液X中 | |
| D. | 沉淀乙可能是Mg(OH)2和Al(OH)3的混合物 |



 .
. ;
;