题目内容
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温下,9g H2O中含NA个O-H键 |
| B、1mol Fe2+与足量稀硝酸反应,转移3NA个电子 |
| C、常温常压下,22.4L SO2和O2的混合气体中含2NA个氧原子 |
| D、0.1mol?L-1 KAl(SO4)2溶液中含0.2NA个SO42- |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.9g水的物质的量为0.5mol,0.5mol水中含有1mol氢氧键;
B.1mol亚铁离子被氧化成铁离子,转移了1mol电子;
C.常温常压下,不能使用标况下的气体摩尔体积计算混合气体的物质的量;
D.缺少硫酸铝钾溶液的体积,无法计算溶液中硫酸根离子的数目.
B.1mol亚铁离子被氧化成铁离子,转移了1mol电子;
C.常温常压下,不能使用标况下的气体摩尔体积计算混合气体的物质的量;
D.缺少硫酸铝钾溶液的体积,无法计算溶液中硫酸根离子的数目.
解答:
解:A.9g水的物质的量为0.5mol,含有1mol氢氧键,含NA个O-H键,故A正确;
B.1mol亚铁离子完全被氧化成铁离子,转移了1mol电子,转移NA个电子,故B错误;
C.不是标准状况下,题中条件无法计算22.4L二氧化硫和氧气的混合气体的物质的量,故C错误;
D.没有告诉硫酸铝钾溶液的体积,无法计算溶液中含有的硫酸根离子的数目,故D错误;
故选A.
B.1mol亚铁离子完全被氧化成铁离子,转移了1mol电子,转移NA个电子,故B错误;
C.不是标准状况下,题中条件无法计算22.4L二氧化硫和氧气的混合气体的物质的量,故C错误;
D.没有告诉硫酸铝钾溶液的体积,无法计算溶液中含有的硫酸根离子的数目,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意题中缺少溶液的体积.

练习册系列答案
相关题目
短周期中的A、B、C、D、E五种元素,原子序数依次增大,A和D,C和E分别同主族,A为非金属元素,且A与B的原子序数之和等于C的原子序数,C2-与D+的核外电子数相等.则下列说法正确的是( )
| A、B与A只能形成化合物BA3 |
| B、C的原子半径、离子半径均分别小于D的原子半径、离子半径 |
| C、A、B、C形成的化合物可能促进水的电离,也可能抑制水的电离 |
| D、A、D均能与C形成原子个数比为1:1、2:1的化合物,且A2C2与D2C2的化学键类型相同 |
下列叙述正确的是( )
| A、在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
B、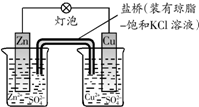 如图中电子由Zn极流向Cu,盐桥中的Cl-移向CuSO4溶液 |
| C、氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O |
| D、电镀时,通常把待镀的金属制品作阳极 |
人体血液中存在平衡:CO2+H2O?H2CO3
HCO3-,使血液pH保持在7.35~7.45之间,否则就会发生酸中毒或碱中毒.已知pH随c(HCO3-):c(H2CO3)变化关系如下表所示,则下列说法中不正确的是( )
| OH- |
| H- |
| c(HCO3-):c(H2CO3) | 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.40 | 7.45 |
| A、pH=7的血液中,c(HCO3-)>c(H2CO3) |
| B、人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒 |
| C、常温下将pH=7.40的血液稀释至pH=7时,c(H+)?c(OH-)一定不变 |
| D、c(HCO3-):c(H2CO3)=1时,H2CO3的电离程度小于HCO3-的水解程度 |
下列说法中,正确的是( )
| A、冰熔化时水分子的共价键未发生断裂 |
| B、同族元素的氧化物形成的晶体类型相同 |
| C、分子晶体中,分子间作用力越大,分子越稳定 |
| D、具有高熔沸点的晶体一定是离子晶体或原子晶体 |
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题: