题目内容
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大.a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有一个电子,但次外层有18个电子.回答下列问题:(1)b、c、d中第一电离能最大的是
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是
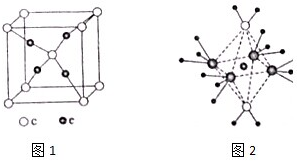
(4)e和c形成的一种离子化合物的晶体结构如图1,则e离子的电荷为
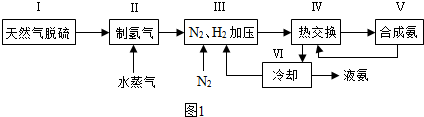
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中,阴离子为
考点:真题集萃,位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,
c的最外层电子数为其内层电子数的3倍,原子最外层电子数是8,所以C是O元素,d与c同族,则d是S元素,
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,再结合原子结构、物质结构、元素周期律解答.
c的最外层电子数为其内层电子数的3倍,原子最外层电子数是8,所以C是O元素,d与c同族,则d是S元素,
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,再结合原子结构、物质结构、元素周期律解答.
解答:
解:周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,则a是H元素,
c的最外层电子数为其内层电子数的3倍,原子最外层电子数是8,所以C是O元素,d与c同族,则d是S元素,
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,
(1)b、c、d分别是N、O、S元素中,元素的非金属性越强,其第一电离能越大,同一周期元素中,第一电离能随着原子序数的增大呈增大趋势,但第VA族元素大于相邻元素,所以N、O、S中第一电离能最大的是N元素,e的价层为3d、4s电子,其电子轨道示意图为 ,
,
故答案为:N; ;
;
(2)a是H元素,a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为氨气,氨气分子中氮原子含有3个共价键和一个孤电子对,所以该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4,
故答案为:sp3;H2O2、N2H4;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3,故答案为:HNO2、HNO3;H2SO3;
(4)e和c形成的一种离子化合物的晶体结构如图1,c离子个数=1+8×
=2,e离子个数=4,所以该化合物为Cu2O,则e离子的电荷为+1,故答案为:+1;
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明阴离子的中心原子价层电子对个数是4且不含孤电子对,为硫酸根离子,阳离子呈轴向狭长的八面体结构(如图2所示),根据图象知,阳离子的配位数是6,阳离子中含有共价键、配位键,氨分子个数是4、水分子个数是2,其化学式为[Cu(NH3)4(H2O)2]SO4,H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,
故答案为:SO42-;共价键和配位键;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱.
c的最外层电子数为其内层电子数的3倍,原子最外层电子数是8,所以C是O元素,d与c同族,则d是S元素,
b的价电子层中的未成对电子有3个,且原子序数小于c,则b是N元素;
e的最外层只有一个电子,但次外层有18个电子,则e是Cu元素,
(1)b、c、d分别是N、O、S元素中,元素的非金属性越强,其第一电离能越大,同一周期元素中,第一电离能随着原子序数的增大呈增大趋势,但第VA族元素大于相邻元素,所以N、O、S中第一电离能最大的是N元素,e的价层为3d、4s电子,其电子轨道示意图为
 ,
,故答案为:N;
 ;
;(2)a是H元素,a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子为氨气,氨气分子中氮原子含有3个共价键和一个孤电子对,所以该分子的中心原子的杂化方式为sp3;分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2、N2H4,
故答案为:sp3;H2O2、N2H4;
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是HNO2、HNO3;酸根呈三角锥结构的酸是H2SO3,故答案为:HNO2、HNO3;H2SO3;
(4)e和c形成的一种离子化合物的晶体结构如图1,c离子个数=1+8×
| 1 |
| 8 |
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,说明阴离子的中心原子价层电子对个数是4且不含孤电子对,为硫酸根离子,阳离子呈轴向狭长的八面体结构(如图2所示),根据图象知,阳离子的配位数是6,阳离子中含有共价键、配位键,氨分子个数是4、水分子个数是2,其化学式为[Cu(NH3)4(H2O)2]SO4,H2O和Cu2+的配位键比NH3与Cu2+的弱,所以该化合物加热时首先失去的组分是H2O,
故答案为:SO42-;共价键和配位键;H2O;H2O和Cu2+的配位键比NH3与Cu2+的弱.
点评:本题考查了晶胞的计算、化学键的判断、电离能的比较等知识点,这些知识点都是高考热点,根据晶胞特点、化学键的构成微粒、元素周期律等知识点来分析解答,难点是(5),正确连接图中表示的微粒是解本题关键,知道其配位数及形成的化学键,题目难度中等.

练习册系列答案
相关题目
NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、常温下,9g H2O中含NA个O-H键 |
| B、1mol Fe2+与足量稀硝酸反应,转移3NA个电子 |
| C、常温常压下,22.4L SO2和O2的混合气体中含2NA个氧原子 |
| D、0.1mol?L-1 KAl(SO4)2溶液中含0.2NA个SO42- |
38Sr(锶)与37Rb(铷)是同周期的相邻元素,下列有关锶的说法错误的是( )
| A、38Sr是第3周期ⅡA族元素 |
| B、Sr的离子半径比Ar的原子半径大 |
| C、Sr的碳酸盐受热会分解 |
| D、Sr的氧化物对应水化物碱性比Rb的氧化物对应水化物碱性弱 |
下列有关说法正确的是( )
| A、若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B、2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C、加热0.1mol?L-1 Na2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D、对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
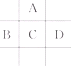 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题: