题目内容
1.下列说法正确的是( )| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
分析 A.吸热反应不一定需要加热也能发生反应;
B.化学变化是旧键断裂新键形成的过程,断键和成键都有能量变化;
C、热化学方程式中应注明各物质的聚集状态;
D、硫固体变为硫蒸气吸收热量,故等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量少.
解答 解:A.Ba(OH)2•8H2O与NH4Cl的反应是吸热反应,但是不需要加热,故A错误;
B.化学变化是旧键断裂新键形成的过程,断键和成键都有能量变化,所以物质的化学变化都伴随着能量的变化,故B正确;
C、热化学方程式中应注明各物质的聚集状态,正确的为:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ•mol-1,故C错误;
D、硫固体变为硫蒸气吸收热量,故等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量少,故D错误;
故选B.
点评 本题考查化学反应中能量的变化、热化学方程式的书写和反应热的大小比较,着重于对概念的理解,注意放热反应、吸热反应与反应条件之间有无必然关系,做题时不要混淆,太慢较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
请回答:
(1)根据表中的实验数据,可以得到的结论是其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大.
(2)表中的V=2.0;利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=0.01(或1.0×10-2)mol/(L•min).
【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | V | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
(1)根据表中的实验数据,可以得到的结论是其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大.
(2)表中的V=2.0;利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=0.01(或1.0×10-2)mol/(L•min).
6.已知七种短周期元素a~g的有关信息如下表所示:
下列推断不正确的是( )
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 金属性的强弱:f<g | |
| C. | 元素e的氧化物只能与酸反应 | |
| D. | 最高价氧化物对应的水化物的碱性:e<g |
13.以惰性电极电解CuSO4溶液.一段时间后取出电极,加入0.1molCu(OH)2固体后溶液与电解前相同,则电解时电路中流过的电子为( )
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 | D. | 0.4 mol |
10.下列反应的离子方程式正确的是( )
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
11.下列反应的离子方程式书写正确的是( )
| A. | 在偏铝酸钠溶液中滴入少量的碳酸氢钠溶液HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在碳酸氢镁溶液中逐滴加入澄清石灰水至过量Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 氢氧化铁固体溶于氢碘酸 Fe(OH)3+3H+=Fe3++3H2O |
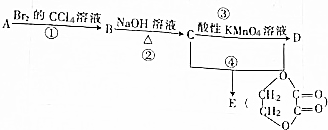 已知:①A的产量通常用来衡量一个国家的石油化工发展水平;
已知:①A的产量通常用来衡量一个国家的石油化工发展水平;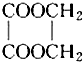 +2H2O,该反应的反应类型是酯化反应或取代反应.
+2H2O,该反应的反应类型是酯化反应或取代反应.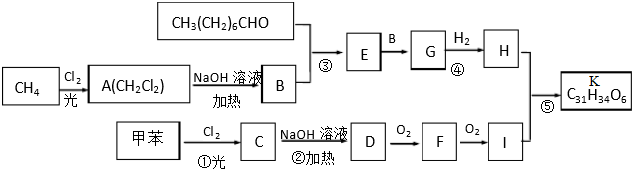
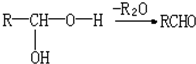
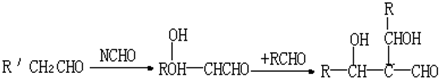
 .
.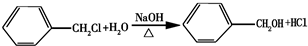
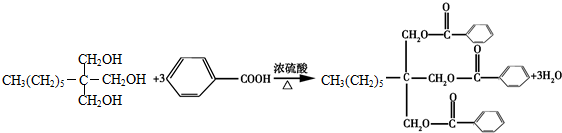
 .
.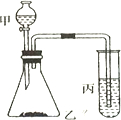 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示