题目内容
12.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
| 0.6 mol/L H2C2O4溶液 | H2O | 3 mol/L 稀硫酸 | 0.05mol/L KMnO4溶液 | ||
| 1 | 3.0 | V | 2.0 | 3.0 | 1.5 |
| 2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
| 3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
(1)根据表中的实验数据,可以得到的结论是其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大.
(2)表中的V=2.0;利用实验1中数据计算,若用KMnO4的浓度变化表示的反应速率为:υ(KMnO4)=0.01(或1.0×10-2)mol/(L•min).
分析 (1)从表中数据可知改变的条件是H2C2O4浓度,根据H2C2O4溶液浓度不同,浓度越大,反应速率越快,浓度越小,反应速率就越慢进行解答;
(2)利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中V=2.00mL;溶液褪至无色即KMnO4反应完所需时间为1.5min,计算出用KMnO4表示的化学反应速率.
解答 解:(1)在表中,其它条件相同,而H2C2O4溶液浓度不同,浓度越大,反应速率越快,浓度越小,反应速率就越慢.因此根据表格的实验数据,可以得到的结论是其他条件不变时,增大反应物浓度,加快化学反应速率,
故答案为:其他条件相同时,增大H2C2O4浓度(或反应物浓度),反应速率增大;
(2)利用实验2、3中的数据,可知溶液的总体积为10.0mL,所以实验1中V=2.00mL;计算用KMnO4表示的化学反应速率为v(KMnO4)=$\frac{△c}{△t}$=$\frac{0.05mol•{L}^{-1}×3.0×1{0}^{-3}L}{10×1{0}^{-3}L×1.5min}$=1.0×10-2mol/(L•min),
故答案为:2.0;1.0×10-2mol/(L•min).
点评 本题主要结合实验考查了影响化学反应速率的因素,题目难度中等,注意掌握浓度对化学反应速率的影响,解题关键是对比分析图表中的数据找出相同点和不同点,然后得出合理结论,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | 丙烯 | B. | 对二甲苯 | C. | 1-甲基-4-乙基苯 | D. | 1-甲基-2-乙基苯 |
18.把Na0H溶液和CuSO4溶液加入某病人的尿液中,加热后观察到砖红色沉淀,说明尿液中含有( )
| A. | 脂肪 | B. | 白酒 | C. | 乙酸 | D. | 葡萄糖 |
7. 在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
(1)t1=50s,画出以时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(2)利用所画的曲线图,总结并得出的关于温度影响反应速率的结论是温度每升高10℃,反应速率加快到原来的2倍;
(3)t1>t4(填“>”或“<”),原因是G组中可形成Cu-Zn原电池,反应速率加快.t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率加快;
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为mF>mE>mB.
 在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:| 编号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶解 的时间/s |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | t1 |
| E | 2 | 细小颗粒 | 15 | t2 |
| F | 2 | 粉末 | 15 | t3 |
| G | 2 | 薄片(含少量杂质Cu) | 35 | t4 |
(2)利用所画的曲线图,总结并得出的关于温度影响反应速率的结论是温度每升高10℃,反应速率加快到原来的2倍;
(3)t1>t4(填“>”或“<”),原因是G组中可形成Cu-Zn原电池,反应速率加快.t2>t3(填“>”或“<”),原因是F组中锌为粉末状,表面积较大,反应速率加快;
(4)单位时间内消耗锌的质量mB、mE、mF从大到小的顺序为mF>mE>mB.
17.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
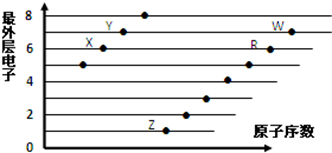

| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
4.四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍.请回答下列问题:
(1)元素Z位于周期表中的位置第三周期第ⅥA族.
(2)实验室制取X元素的简单氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)硒是人体必需的微量元素,与Y同主族,硒原子比Y原子多两个电子层,则硒的原子序数34.
(4)将过量的W的单质通入FeBr2的溶液中,发生反应的离子方程式2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl-.
| X | Y | |
| Z | W |
(2)实验室制取X元素的简单氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)硒是人体必需的微量元素,与Y同主族,硒原子比Y原子多两个电子层,则硒的原子序数34.
(4)将过量的W的单质通入FeBr2的溶液中,发生反应的离子方程式2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl-.
1.下列说法正确的是( )
| A. | 凡是吸热反应都需要加热 | |
| B. | 物质的化学变化都伴随着能量变化 | |
| C. | 表示中和热的热化学方程式:NaOH+HCl═NaCl+H2O△H=-57.3 kJ•mol-1 | |
| D. | 等质量的硫蒸气和硫固体分别完全燃烧,前者的反应热比后者大 |
2.下列实验装置设计正确、且能达到目的是( )
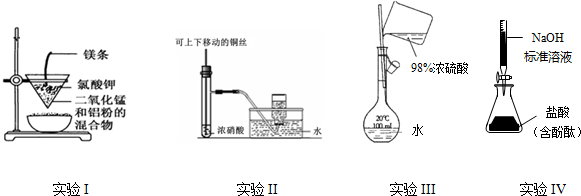

| A. | 实验I:制备金属锰 | |
| B. | 实验II:制备并收集NO2 | |
| C. | 实验III:配置一定的物质的量浓度的稀硫酸溶液 | |
| D. | 实验IV:测定未知盐酸的浓度 |