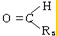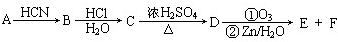题目内容
钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
考点:化学方程式的有关计算
专题:
分析:(1)发生反应:2Na+2H2O=2NaOH+H2↑、2K+2H2O=2KOH+H2↑,由方程式可知n(OH-)=2n(H2),再根据c=
计算溶液中氢氧根离子浓度;
(2)设上述合金中Na为amol、K为bmol,根据二者质量及生成氢气的物质的量列方程计算,进而确定合金的化学式.
| n |
| V |
(2)设上述合金中Na为amol、K为bmol,根据二者质量及生成氢气的物质的量列方程计算,进而确定合金的化学式.
解答:
解:(1)发生反应:2Na+2H2O=2NaOH+H2↑、2K+2H2O=2KOH+H2↑,由方程式可知n(OH-)=2n(H2)=0.075mol×2=0.15mol,
故溶液中c(OH-)=
=0.75mol/L,
答:溶液中氢氧根离子的浓度为0.75mol/L.
(2)设上述合金中Na为amol、K为bmol,则:
解得a=0.05,b=0.1
则Na与K的物质的量之比=0.05mol:0.1mol=1:2,
故该合金的化学式为NaK2,
答:该钠-钾合金的化学式为NaK2.
故溶液中c(OH-)=
| 0.15mol |
| 0.2L |
答:溶液中氢氧根离子的浓度为0.75mol/L.
(2)设上述合金中Na为amol、K为bmol,则:
|
解得a=0.05,b=0.1
则Na与K的物质的量之比=0.05mol:0.1mol=1:2,
故该合金的化学式为NaK2,
答:该钠-钾合金的化学式为NaK2.
点评:本题以核反应堆中热交换液钠-钾合金为载体,考查根据方程式进行的计算,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
反应:CaCl2+CO2+H2O=CaCO3+2HCl在任何情况下都不能发生反应,原因是该反应( )
| A、△H>0△S>0 |
| B、△H<0△S<0 |
| C、△H<0△S>0 |
| D、△H>0△S<0 |
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: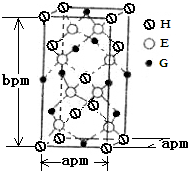 A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题:
A、B、D、E、G、H均是前四周期的元素.在所有前四周期的基态原子中A的未成对电子最多;B基态原子的L电子层的p能级上有一个空轨道;D 的基态原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E的基态原子M层有6种运动状态不同的电子; G在周期表中位于第8列,H的原子序数比G大3.根据信息回答下列问题: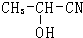
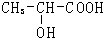
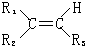
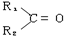 +
+