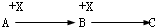题目内容
如图表示反应X(g)?4Y(g)+Z(g),在 200℃和a℃时,X的浓度随时间变化的曲线
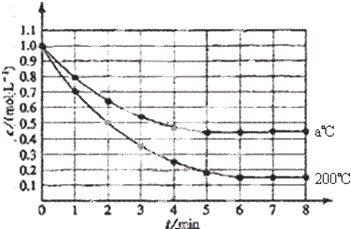
(1)200℃时,5min内用Y表示平均反应速率 .
(2)200℃在8min时,Z的浓度为 .
(3)200℃在 时刻,反应达到平衡.
(4)200℃时,第7min时刻,V(正) V(逆)(填“>”、“<”、“=”).
(5)从图中可以看出,a 200(填“>”、“<”、“=”).

(1)200℃时,5min内用Y表示平均反应速率
(2)200℃在8min时,Z的浓度为
(3)200℃在
(4)200℃时,第7min时刻,V(正)
(5)从图中可以看出,a
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)计算5min内X反应速率,利用计量数之比计算Y的反应速率;
(2)计算X的浓度变化,利用计量数之比计算Z的浓度;
(3)X的浓度不再发生变化时,达到化学平衡状态;
(4)7min达到化学平衡状态,判断正逆反应速率大小;
(5)先达到化学平衡状态,温度越高.
(2)计算X的浓度变化,利用计量数之比计算Z的浓度;
(3)X的浓度不再发生变化时,达到化学平衡状态;
(4)7min达到化学平衡状态,判断正逆反应速率大小;
(5)先达到化学平衡状态,温度越高.
解答:
解:(1)5min内X浓度变化为1.0mol/L-0.2mol/L=0.8mol/L,v(X)=
=0.016mol?L-1?min-1,v(Y)=4×0.016mol?L-1?min-1=0.64mol?L-1?min-1,
故答案为:0.64mol?L-1?min-1;
(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,故答案为:0.85mol/L;
(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,故答案为:6min;
(4)7min达到化学平衡状态,V(正)=V(逆),故答案为:V(正)=V(逆);
(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,故答案为:>.
| 0.8mol/L |
| 5min |
故答案为:0.64mol?L-1?min-1;
(2)X与Z计量数之比为1:1,则Z的浓度与X的消耗浓度相等,即c(Z)=△c(X)=0.85mol/L,故答案为:0.85mol/L;
(3)X的浓度不再发生变化时,达到化学平衡状态,第6min时,X浓度不再变化,故答案为:6min;
(4)7min达到化学平衡状态,V(正)=V(逆),故答案为:V(正)=V(逆);
(5)温度越高,化学反应速率越快,达到化学平衡时间越短,图象中a℃先达到平衡状态,故a>200,故答案为:>.
点评:本题考查化学反应速率及化学平衡图象,注意把握曲线的变化趋势,正确判断外界条件对平衡移动的影响.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
下面所列的电子层中能量最低的是( )
| A、K层 | B、L 层 |
| C、M层 | D、N层 |
下列各组物质,属于电解质的是( )
| A、NaCl |
| B、铜 |
| C、蔗糖 |
| D、CO2 |