题目内容
煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
请回答下列同题:
(1)该反应的化学平衡常数表达式K= .
(2)上述正反应是 反应(填“放热”或“吸热”).
(3)能判断该反应已经达到化学平衡状态的是 .
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为 ℃.
(5)已知在一定温度下:
C(s)+CO2(g)?2CO(g)平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;则K1、K2、K之间的关系是 .
已知:CO(g)+H2O(g)?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)该反应的化学平衡常数表达式K=
(2)上述正反应是
(3)能判断该反应已经达到化学平衡状态的是
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
(5)已知在一定温度下:
C(s)+CO2(g)?2CO(g)平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;则K1、K2、K之间的关系是
考点:化学平衡状态的判断,化学平衡常数的含义,化学平衡的影响因素
专题:化学平衡专题
分析:(1)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
(2)根据平衡常数随温度的变化进行判断;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(4)根据化学平衡常数解答;
(5)根据化学平衡常数解答.
(2)根据平衡常数随温度的变化进行判断;
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(4)根据化学平衡常数解答;
(5)根据化学平衡常数解答.
解答:
解:(1)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,故K=
,
故答案为:(1)K=
;
(2)升高温度,平衡常数减小,平衡逆向移动,故正反应为放热反应,
故答案为:放热;
(3)A.因该反应为反应前后气体体积不变的反应,故容器中压强不变不能作为平衡状态的判据,故A错误;
B.混合气体中CO浓度不变,表明各组分的浓度不再变化,达到了平衡状态,故B正确;
C.v正(H2)=v正(H2O),不能作为平衡状态的判据,故C错误;
D.c(CO2)=c(CO)不能判断化学平衡状态,和起始量有关,故D错误,
故答案为:B;
(4)c(CO2)?c(H2)=c(CO)?c(H2O),即
=1,故,此时的温度为850℃,
故答案为:850;
(5)①C(s)+CO2(g)?2CO(g)平衡常数K1;
②C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
③CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;
③=②-①,故K=
,
故答案为:K=
.
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
故答案为:(1)K=
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
(2)升高温度,平衡常数减小,平衡逆向移动,故正反应为放热反应,
故答案为:放热;
(3)A.因该反应为反应前后气体体积不变的反应,故容器中压强不变不能作为平衡状态的判据,故A错误;
B.混合气体中CO浓度不变,表明各组分的浓度不再变化,达到了平衡状态,故B正确;
C.v正(H2)=v正(H2O),不能作为平衡状态的判据,故C错误;
D.c(CO2)=c(CO)不能判断化学平衡状态,和起始量有关,故D错误,
故答案为:B;
(4)c(CO2)?c(H2)=c(CO)?c(H2O),即
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
故答案为:850;
(5)①C(s)+CO2(g)?2CO(g)平衡常数K1;
②C(s)+H2O(g)?CO(g)+H2(g)平衡常数K2;
③CO(g)+H2O(g)?H2(g)+CO2(g)平衡常数K;
③=②-①,故K=
| K2 |
| K1 |
故答案为:K=
| K2 |
| K1 |
点评:本题考查平衡常数及其相关计算、平衡移动原理、平衡标志的判断等,难度中等.要注意化学平衡的特征.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
钠-钾合金可在核反应堆中用作热交换液.5.05g钠-钾合金溶于200mL水生成0.075mol氢气.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
(1)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化).
(2)计算并确定该钠-钾合金的化学式.
下列反应中符合H++OH-=H2O离子反应的是( )
| A、稀硫酸与稀氨水 |
| B、稀硫酸与氢氧化钡溶液 |
| C、稀硝酸与氢氧化钡溶液 |
| D、盐酸与氢氧化铁反应 |
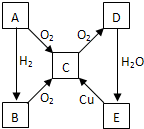 A、B、C、D、E各物质的转化关系如图所示.
A、B、C、D、E各物质的转化关系如图所示.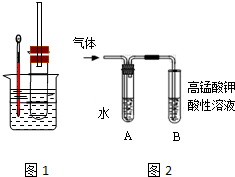 用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质: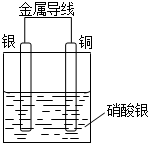 某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.
某同学设计出如下装置成功的证明了Cu和Ag的金属活动性顺序.请你原电池原理和实验装置,完成下列实验报告.