题目内容
13.下列说法正确的是( )| A. | HCl溶于水能电离出H+、Cl-,所以HCl是离子化合物 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | He、CO2和CH4都是由分于构成,它们中都存在共价键 | |
| D. | NaHCO3受热分解生成Na2CO3、CO2和H2O,旣破坏了离子键,也破坏了共价键 |
分析 A.HCl属于共价化合物,可发生电离;
B.碘晶体受热转变成碘蒸气,克服分子间作用力;
C.He为单原子分子,不存在共价键;
D.NaHCO3为离子化合物,含有离子键和共价键.
解答 解:A.HCl属于共价化合物,属于电解质,在溶液中可发生电离,故A错误;
B.碘晶体受热转变成碘蒸气,克服分子间作用力,而碘原子间的作用力属于共价键,故B错误;
C.He为单原子分子,不存在共价键,故C错误;
D.NaHCO3为离子化合物,含有离子键和共价键,受热分解生成Na2CO3、CO2和H2O,阴阳离子间的离子键断裂,生成二氧化碳和水,破坏共价键,故D正确.
故选D.
点评 本题考查了离子键、共价键的区别,为高频考点,侧重考查学生对概念的辨别能力,离子化合物中可能含有共价键,分子间作用力不属于化学键,同时注意把握物质的性质,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.N A表示阿伏加德罗常数的值,下列判断正确的是( )
| A. | 标准状况下,2.24 L 16O 2和3.6 g 18O 2均含有0.2N A个氧原子 | |
| B. | 1.7 g H 218O 2中含有的电子数为0.9 N A | |
| C. | 电解精炼铜时,若阴极得到N A个电子,则阳极质量减少32g | |
| D. | 标准状况下,2.24 L甲烷、戊烷混合物所含分子数为0.1N A |
1.某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol•L-1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
(1)溶液中含有Na2CO3的质量为1.06g;
(2)Na2CO3和NaHCO3的混合溶液中c(HCO3-)为1.00mol•L-1.
| 反应阶段 | Ⅰ | Ⅱ | Ⅲ |
| 稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
| 现 象 | 无气体 | 有气体 | 无气体 |
(2)Na2CO3和NaHCO3的混合溶液中c(HCO3-)为1.00mol•L-1.
8.已知氯气与NaOH溶液反应可生成NaCl、NaClO、NaClO3,NaClO在加热条件下分解生成NaCl和NaClO3,现向氢氧化钠溶液中通入一定量的氯气,加热少许时间后溶液中形成混合体系.下列判断不正确的是( )
| A. | 若反应过程中消耗1mol氯气,则1mol<转移电子数<$\frac{5}{3}$mol | |
| B. | 反应停止后n(NaClO):n(NaCl):n(NaClO3)(物质的量之比)可能为1:11:2 | |
| C. | 反应过程中消耗氯气与NaOH的物质的量之比为1:2 | |
| D. | 氧化产物为NaClO和NaClO3,反应过程中n(NaClO):(NaClO3)为1:1 |
18.稀土作为战略性资源,被我国列为保护性开采的特殊矿种,被人们称为新材料的“宝库”,很多国家将其列为发展高新技术产业关键性的元素.我县稀土资源尤为丰富,下列有关稀土元素14462Sm与15062Sm的说法正确的是( )
| A. | 14462Sm与15062Sm互为同位素 | |
| B. | 14462Sm与15062Sm互为同分异构体 | |
| C. | 14462Sm与15062Sm是同一种核素 | |
| D. | 14462Sm与15062Sm的核外电子数和中子数均为62 |
5.下列数据大小比较不正确的是( )
| A. | 沸点:H2O>H2Se>H2S | B. | 熔点:Na>Mg>Al | ||
| C. | 晶格能:NaF>NaCl>NaBr | D. | 硬度:MgO>CaO>BaO |
16.下列关于Na2CO3、NaHCO3说法正确的是( )
| A. | 受热时Na2CO3较NaHCO3更不稳定,更易分解产生CO2 | |
| B. | 等质量的Na2CO3、NaHCO3与足量盐酸反应,前者产生的CO2更多 | |
| C. | 常温下相同物质的量浓度的Na2CO3、NaHCO3溶液,前者碱性更强 | |
| D. | 向Na2CO3、NaHCO3溶液中分别滴加澄清石灰水,前者产生白色沉淀,后者无沉淀 |
17.在一定条件下,容积为2L的密闭容器中,将2mol M气体和3mol N气体混合,发生下列反应:2M(g)+3N(g)?xQ(g)+3R(g),该反应达到平衡时生成2.4mol R,并测得Q浓度 为0.4mol•L-1,下列叙述正确的是( )
| A. | X值为2 | B. | 容器内压强不变 | ||
| C. | 平衡时N的浓度为0.6mol/L | D. | M的转化率为80% |
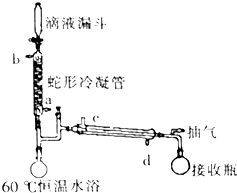 过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下:
过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下: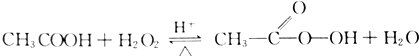 ,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.