题目内容
常温下,0.1mol/L碳酸氢钠溶液中,下列关系正确的是( )
| A、c(Na+)=c(HCO3-) |
| B、c(HCO3-)+2c(CO32-)=0.1mol/L |
| C、c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A、碳酸氢根离子会发生水解反应;
B、根据溶液中的物料守恒来回答;
C、根据电荷守恒来判断;
D、根据溶液中离子浓度大小关系来判断.
B、根据溶液中的物料守恒来回答;
C、根据电荷守恒来判断;
D、根据溶液中离子浓度大小关系来判断.
解答:
解:A、碳酸钠溶液中,碳酸氢根离子会发生水解反应,所以钠离子浓度大于碳酸氢根离子浓度,故A错误;
B、溶液中的物料守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/,故B错误;
C、溶液中存在电荷守恒c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D、碳酸氢钠中碳酸氢根离子的水解程度大于其电离程度,离子浓度大小关系是:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故D错误.
故选C.
B、溶液中的物料守恒:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/,故B错误;
C、溶液中存在电荷守恒c(H+)+c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D、碳酸氢钠中碳酸氢根离子的水解程度大于其电离程度,离子浓度大小关系是:c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+),故D错误.
故选C.
点评:本题涉及盐的水解原理的应用以及离子浓大小比较的知识,属于综合知识的考查,难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
如图所示,若关闭Ⅰ阀,打开Ⅱ阀,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭Ⅱ阀打开Ⅰ阀,再通入这种气体,布条褪色.甲瓶中所盛的试剂不可能是 ( )
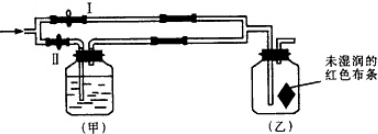

| A、浓H2SO4 |
| B、NaCl溶液 |
| C、Ba(OH)2溶液 |
| D、NaOH溶液 |
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )
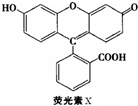

| A、荧光素的分子式为C20H14O5 |
| B、1molX最多能与9mol氢气反应 |
| C、1molX与足量的浓溴水反应,最多消耗4molBr2 |
| D、X能与甲醛发生缩聚反应 |
现向一含有Cu2+、Ca2+的混合溶液中滴入Na2CO3溶液,若首先生成CuCO3沉淀,据此可以得出的结论是( )
| A、Km(CuCO3)<Km(CaCO3) | ||||
| B、C[Cu2+]<c[Ca2+] | ||||
C、
| ||||
D、
|