题目内容
9.常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )| A. | C2H5OH | B. | CH4 | C. | C2H4O | D. | C3H8 |
分析 设有机物的通式为CxHyOz(z可以为0)燃烧通式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2→xCO2+$\frac{y}{2}$H2O,则1mol有机物的耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,据此对各选项进行分析.
解答 解:设有机物的通式为CxHyOz(z可以为0)燃烧通式为:CxHyOz+(x+$\frac{y}{4}$-$\frac{z}{2}$)O2→xCO2+$\frac{y}{2}$H2O,则1mol有机物的耗氧量为(x+$\frac{y}{4}$-$\frac{z}{2}$)mol,
A.1molC2H5OH消耗氧气的物质的量为:(2+$\frac{6}{4}$-$\frac{1}{2}$)mol=3mol;
B.1molCH4消耗氧气的物质的量为:(1+$\frac{4}{4}$)mol=2mol;
C.1molC2H4O消耗氧气的物质的量为:(2+$\frac{4}{4}$-$\frac{1}{2}$)mol=2.5mol;
D.1molC3H8耗消耗氧气的物质的量为:(3+$\frac{8}{4}$)mol=5mol;
根据分析可知,相同物质的量的有机物在足量氧气中燃烧,C3H8消耗氧气最多,
故选D.
点评 本题考查化学方程式的计算,题目难度不大,注意有机物燃烧的化学方程式的书写以及通式的利用,试题有利于提高学生的分析能力及化学计算能力.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
19.在通常条件下,下列各组物质的性质排列正确的是( )
| A. | 热稳定性:HF>H2O>NH3 | B. | 原子半径:F>O>N | ||
| C. | 沸点:乙烷>戊烷>丁烷 | D. | 酸性:H2SO4>H3PO4>HClO4 |
20.工业上生产Na、Ca、Mg都用电解熔融的氯化物,但K不能用电解熔融态的方法得到,因金属钾易溶于熔融态的KCl而有危险,很难制得K,且降低电流效率.现生产钾是用金属钠和KCl在850℃反应制取,有关的反应式为:KCl+Na=NaCl+K↑下列说法错误的是( )
| A. | 该反应850℃的选择是基于熔沸点的考虑 | |
| B. | 该反应不能在空气中进行 | |
| C. | 该反应属于置换反应的类型 | |
| D. | 该反应表明钠比钾的活动性强 |
17.将铜和碳的混合物在空气中充分灼烧,混合物的质量在冷却后没有变化,则原混合物中铜和碳的质量比为( )
| A. | 1:1 | B. | 1:4 | C. | 4:1 | D. | 无法确定 |
4.如表是A、B、C、D、E五种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
.
(4)C与E反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应;
(5)写出由C氧化生成D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为; ③能与水在一定条件下反应生成C ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为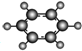 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为 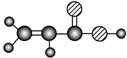 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大
⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应;
(5)写出由C氧化生成D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
14.0.1mol•L-1CH3COOH溶液中,如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A. | 加入水时,溶液中离子浓度都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol•L-1CH3COOH溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡常数减小 |
1.下列叙述中不正确的是( )
| A. | 电镀时,电镀池里的阳极材料发生氧化作用 | |
| B. | 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 | |
| C. | 惰性电极电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 | |
| D. | 电解熔融的氧化铝制取金属铝,用铁作阳极 |
18.下列关于原子结构及微粒间的数量关系的说法错误的是( )
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 微粒Na+、Mg2+、O2-具有相同的电子层结构 | |
| C. | 短周期第ⅣA与ⅥIA族元素的原子间构成的分子,均满足原子最外层8电子结构 | |
| D. | ${\;}_{20}^{48}$Ca2+的中子数比核外电子数多10 |