题目内容
实验室用固体烧碱配制500mL 0.100mol/L的NaOH溶液.
(1)需称量 g烧碱,应放于 (填仪器名称)中在托盘天平上称量.
(2)配制过程中,不需要的仪器(填写代号) .
A.药匙 B.胶头滴管 C.玻璃棒 D.漏斗
(3)根据实验需要和(1)(2)所列仪器判断,完成实验还缺少的仪器是 .
(4)配制NaOH溶液时,下列操作情况会使结果偏高的是 .
A.NaOH固体溶解后,溶液未经冷却就立即移液至容量瓶中并定容
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
(1)需称量
(2)配制过程中,不需要的仪器(填写代号)
A.药匙 B.胶头滴管 C.玻璃棒 D.漏斗
(3)根据实验需要和(1)(2)所列仪器判断,完成实验还缺少的仪器是
(4)配制NaOH溶液时,下列操作情况会使结果偏高的是
A.NaOH固体溶解后,溶液未经冷却就立即移液至容量瓶中并定容
B.移液前,容量瓶中有少量蒸馏水未倒出
C.定容时,俯视容量瓶刻度线观察液面
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)依据n=C×V、m=n×M计算氢氧化钠的质量,氢氧化钠具有腐蚀性,应放在小烧杯中称量;
(2)依据配制一定物质的量浓度溶液所需仪器解答;
(3)依据配制一定物质的量浓度溶液所需仪器解答;
(4)根据c=
判断对所配溶液浓度的影响.
(2)依据配制一定物质的量浓度溶液所需仪器解答;
(3)依据配制一定物质的量浓度溶液所需仪器解答;
(4)根据c=
| n |
| V |
解答:
解:(1)配制500mL 0.100mol/L的NaOH溶液,需要氢氧化钠的物质的量n=C×V=0.100mol/L×0.5L=0.05mol,其质量m=n×M=0.05mol×40g/mol=2.0g;氢氧化钠具有腐蚀性,应放在小烧杯中称量;
故答案为:2.0;烧杯;
(2)配制一定物质的量浓度溶液所需仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;不需要漏斗;
故答案为:D;
(3)配制500mL 0.100mol/L的NaOH溶液,应选择500ml的容量瓶,故答案为:500ml容量瓶;
(4)依据c=
可知:
A.NaOH固体溶解后,溶液未经冷却就立即移液至容量瓶中并定容,此操作会使溶液的体积偏小,浓度偏高,故A正确;
B.移液前,容量瓶中有少量蒸馏水未倒出,对溶液的体积和物质的量都不会产生影响,故B错误;
C.定容时,俯视容量瓶刻度线观察液面,会使溶液的体积偏小,浓度偏高,故C正确;
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,导致所配溶液体积偏大,浓度偏低,故D错误;
故答案为:AC.
故答案为:2.0;烧杯;
(2)配制一定物质的量浓度溶液所需仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;不需要漏斗;
故答案为:D;
(3)配制500mL 0.100mol/L的NaOH溶液,应选择500ml的容量瓶,故答案为:500ml容量瓶;
(4)依据c=
| n |
| V |
A.NaOH固体溶解后,溶液未经冷却就立即移液至容量瓶中并定容,此操作会使溶液的体积偏小,浓度偏高,故A正确;
B.移液前,容量瓶中有少量蒸馏水未倒出,对溶液的体积和物质的量都不会产生影响,故B错误;
C.定容时,俯视容量瓶刻度线观察液面,会使溶液的体积偏小,浓度偏高,故C正确;
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,再加水定容,导致所配溶液体积偏大,浓度偏低,故D错误;
故答案为:AC.
点评:本题考查了配制一定物质的量浓度溶液,明确配制的原理、熟悉实验步骤是解题关键,注意误差分析是难点.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
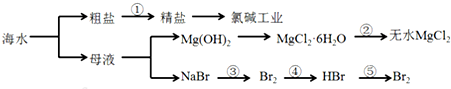
从海水中提取部分物质的过程如图所示
下列有关说法不正确的是( )

下列有关说法不正确的是( )
| A、从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B、过程②中结晶出的MgCl2?6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C、经过③④实现了溴元素的富集 |
| D、电解MgCl2溶液制取Mg单质 |
下列说法错误 的是( )
| A、氯气呈黄绿色,而氯离子无色 |
| B、氯气有毒,但氯离子无毒 |
| C、氯水是液体,所以又叫液氯 |
| D、氯气、氢气和氧气比较起来,氯气容易液化 |