题目内容
在高温下,下列反应达到平衡:C(s)+H2O(g)?H2(g)+CO(g) (正反应为吸热反应)
如果升高温度,由于 ,所以平衡向 移动;如果增大压强,由于 ,所以平衡向 移动.
如果升高温度,由于
考点:化学平衡的影响因素
专题:化学平衡专题
分析:化学反应的特征是反应前后气体体积增大的吸热反应,依据化学平衡移动原理分析判断.
解答:
解:在高温下,下列反应达到平衡:C(s)+H2O(g)═CO(g)+H2(g)(正反应为吸热反应).如果升高温度,平衡向吸热反应方向进行,所以平衡正向进行;增大压强平衡向气体体积减小的方向进行,平衡逆向进行;故答案为:正反应为吸热反应;正反应方向;正反应是气体体积减小的反应;逆反应方向.
点评:本题考查了化学平衡影响因素的分析判断,化学平衡移动原理是解题关键,题目较简单.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列说法不正确的是( )
| A、Mg的金属性比Al强 |
| B、H2S的热稳定性比H2O强 |
| C、Na的原子半径比N原子大 |
| D、HClO4的酸性比H3PO4强 |

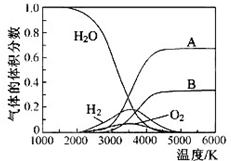 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.